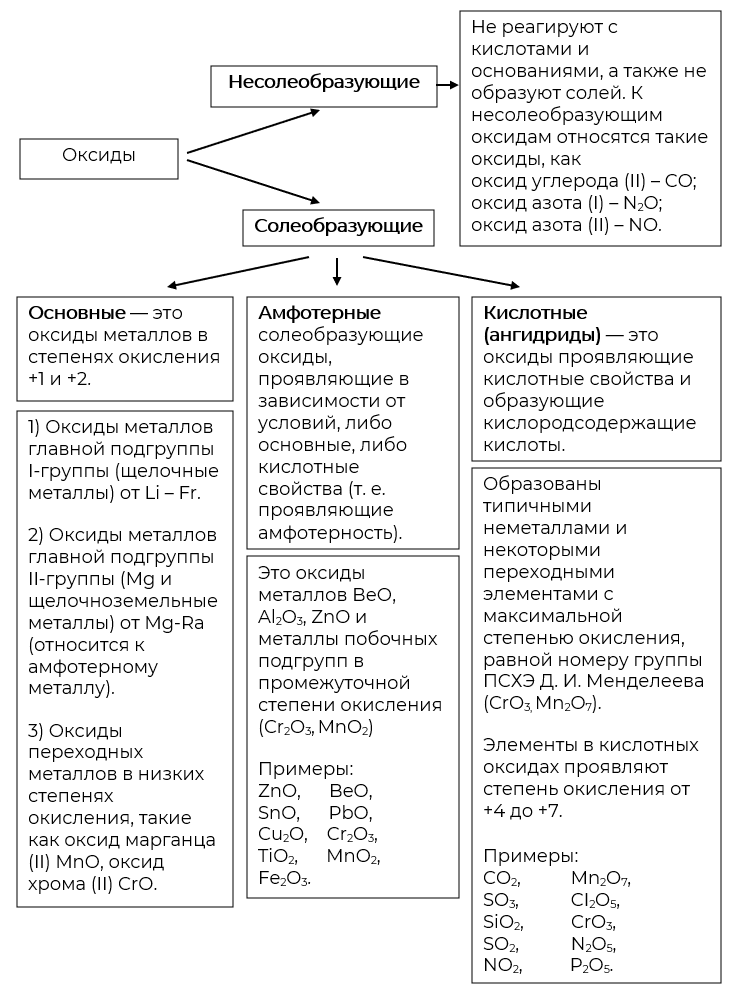
- Классификация оксидов
- Химические свойства оксидов
- обобщить и систематизировать знания о классификации оксидов
- изучить химические свойства кислотных и основных оксидов
- Дайте определение оксидов.
- В каком агрегатном состоянии встречаются оксиды?
- Из приведённых формул выберите формулы оксидов и назовите их: H2SO4, NaOH, CuO, Na2SO4, O2, SO3, HCl, Na2O.
Классификация оксидов
Ты не имеешь ни вкуса, ни цвета, ни запаха, тебя невозможно описать — тобой наслаждаешься, не ведая, что ты такое. Ты не просто необходима для жизни, ты и есть сама жизнь.
Как вы думаете, о каком веществе написал Антуан де Сент-Экзюпери такие слова? Ответ очень прост — вода.
Вода покрывает 71 % площади поверхности Земли. На 60–80 % организм человека состоит из воды (в зависимости от возраста). Вода играет огромную роль в жизни человека и в жизни всех живых организмов на Земле.
А к какому классу неорганических соединений относится вода? (Оксиды.) Познакомимся с классификацией оксидов по химическим свойствам и узнаем, с какими соединениями могут вступать во взаимодействие оксиды.
Классификация оксидов по химическим свойствам
Химические свойства оксидов
I. Основные оксиды (о. о.)
- О. о. + кислота = соль + вода:
- О. о. + вода = щёлочь (растворимое основание):
если образуется нерастворимое основание, то такая реакция не пойдёт. Например, если налить в две пробирки воды и капнуть туда несколько капель лакмуса, а затем поместить в первую пробирку оксид кальция, а в другую оксид меди (II), то реакция у нас идёт только в первой пробирке, т. к. образовалась щёлочь и лакмус изменил свою окраску на синюю, во второй пробирке изменений нет, т. к. оксид меди (II) не реагирует с водой, ведь Cu(OH)2 — нерастворимое в воде основание.
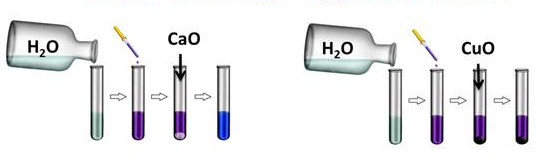 Рис. 1. Взаимодействие основных оксидов с водой
Рис. 1. Взаимодействие основных оксидов с водой
- О. о. + кислотный оксид = соль:
.
II. Кислотные оксиды (к. о.)
- К. о. + основание = соль + вода:
.
- К. о. + вода = кислота (кроме SiO2):
эти реакции возможны, если оксид растворим в воде. Для подтверждения нальём в одну пробирку дистиллированной воды, а в другую — раствор углекислого газа (газированной воды). В первую пробирку добавим оксида кремния (IV). А затем в каждую из пробирок добавим несколько капель лакмуса. В первой пробирке изменений нет, а во второй лакмус окрасился в красный цвет, значит, во второй пробирке кислота. В первой пробирке кислоты не образовалось, потому что оксид кремния (IV) не растворим в воде.
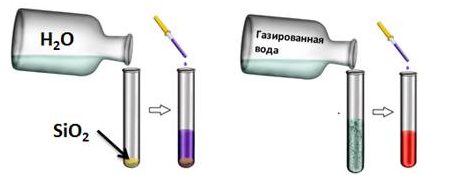 Рис.2. Взаимодействие кислотных оксидов с водой.
Рис.2. Взаимодействие кислотных оксидов с водой.
- К. о. + основный оксид = соль:
.
- Вытеснение менее летучими кислотными оксидами более летучих из их солей:
.
Амфотерные оксиды реагируют с кислотными оксидами и кислотами также как основные.
Каждому кислотному оксиду соответствует определённая кислота. Например:
,
,
,
,
.
Каждому основному оксиду соответствует определённое основание. Например:
,
,
,
,
.
Эти оксиды при взаимодействии с водой образуют соответствующие кислоты или основания. Например:
,
.
Пример 1
Формула основного оксида: а) Na2O; б) CO2; в) SO3.
Основный оксид — оксид металла из представленных соединений — а) Na2O.
Пример 2
Какой из кислотных оксидов не взаимодействует с водой а) SO2; б) CO2; в) SiO2?
С водой не реагирует песок (кремнезём), он не растворяется в воде:
в) SiO2.
Пример 3
Допишите уравнение реакции .
ВаО — основный оксид, реагирует с водой, так как в результате реакции образуется растворимое основание (щёлочь) гидроксид бария Ba(OH)2.
Пример 4
Допишите уравнение реакции: .
В результате взаимодействия основного и кислотного оксидов, реакция соединения, образуется соль — карбонат кальция CaCO3.
Упражнение
- Выберите формулу кислотного оксида: а) Na2O; б) МgO; в) SO3.
- Выберите основный оксид, который не взаимодействует с Н2О: а)Na2О; б) СаO; в) Fe2O3.
- Закончите реакцию взаимодействия .
- Допишите уравнение реакции .
Контрольные вопросы
- С какими соединениями могут взаимодействовать основные оксиды?
- Какие основные оксиды не взаимодействуют с водой?
- С какими соединениями могут взаимодействовать кислотные оксиды?
- Какой кислотный оксид не взаимодействует с водой?
Упражнение
- В
- В

