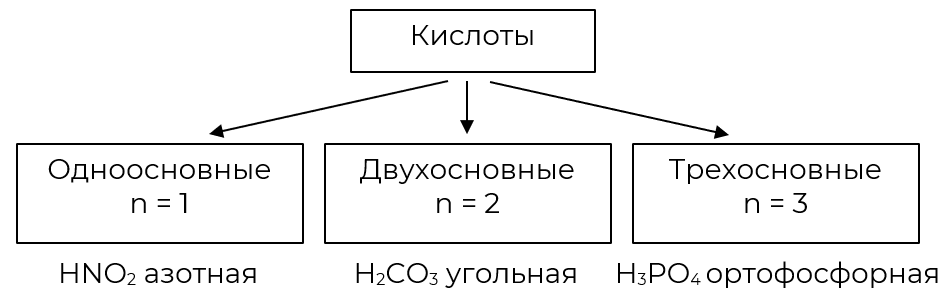
- Классификация кислот
- Химические свойства кислот
- обобщить и систематизировать знания о классификации кислот
- изучить химические свойства кислот
- Какие вещества называются кислотами?
- Какие бывают кислоты?
Классификация кислот
Вы уже знакомы классом химических соединений “кислоты”. На данном этапе необходимо обобщить уже имеющиеся знания о кислотах и познакомимся с химическими свойствами кислот.
Классификация кислот по основности (по количеству атомов водорода)
Химические свойства кислот
|
 Рис. 1. Действие индикатора лакмуса в кислой среде
Рис. 1. Действие индикатора лакмуса в кислой среде
|
2. Кислота + металл = соль + водород
Практическим путём учёные смогли выяснить, какие металлы вытесняют водород из растворов кислот. Был составлен электрохимический ряд напряжения металлов, или ряд активности металлов Н. Н. Бекетова — по имени русского учёного, в XX веке изучавшего взаимодействие металлов со сложными веществами.
Электрохимический ряд напряжений металлов
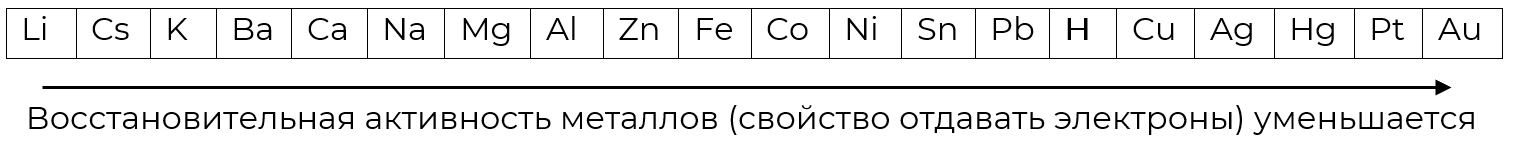
Если металл находится в ряду до водорода, то он реагирует с кислотами, если после, то нет. Запомните: чем левее стоит металл, тем активнее он вытесняет водород.
3. Кислота + основный оксид = соль + вода
4. Кислота + растворимое основание (щелочь) = соль+ вода
К 2–3 мл раствора гидроксида калия добавляем 2–3 мл раствора фенолфталеина. Как изменилась окраска? Стала малиновой.
По каплям добавляем раствор серной кислоты и следим за исчезновением окраски. Что происходит при постепенном приливании раствора кислоты? Происходит нейтрализация раствора — малиновый цвет исчезает.
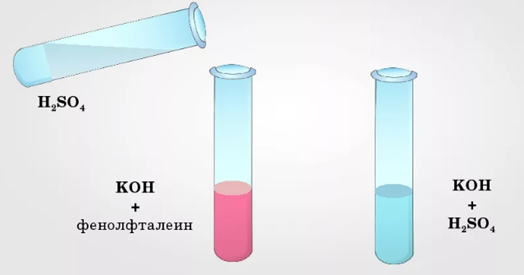 Рис. 2. Реакция нейтрализации между кислотой и щёлочью
Рис. 2. Реакция нейтрализации между кислотой и щёлочью
5. Кислота + нерастворимое основание = соль + вода
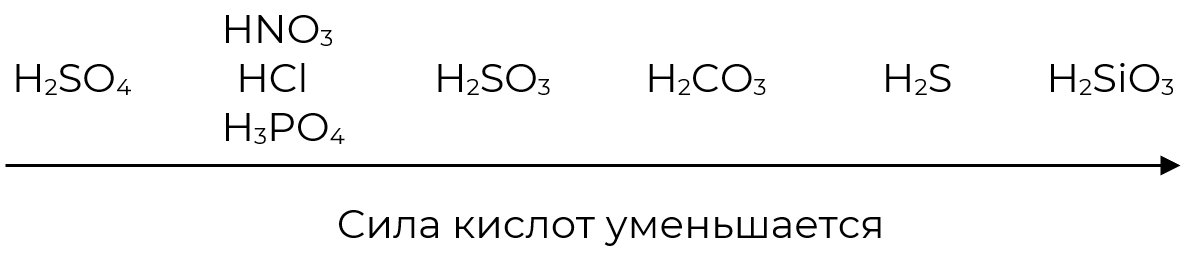
6. Кислота + соль = новая соль + новая кислота
Для составления уравнений реакций кислот с солями следует пользоваться рядом вытеснения кислот, в котором каждая предыдущая может вытеснить из соли последующую.
Ряд вытеснения кислот
Пример 1
Какое вещество лишнее? Назовите его, ответ объясните.
а)
б)
Решение:
а) — кислородсодержащая кислота;
б) — бескислородная кислота.
Пример 2
Допишите уравнения реакций:
а)
б)
в)
Решение:
а)
б) реакция не идёт, так как все вещества растворимы
в)
Упражнение
- Какое вещество лишнее? Назовите его, ответ объясните.
а)
б)
- Допишите уравнения реакций:
1)
2)
3)
Контрольные вопросы
- Может ли выделить водород из раствора соляной кислоты алюминий и почему?
- Будет ли реагировать с серной кислотой золото?
- Какой элемент будет реагировать активнее: цинк или свинец?
Упражнение
- а) — трёхосновная кислота;
б) — кислородсодержащая кислота.
- 1)
2)
3)

