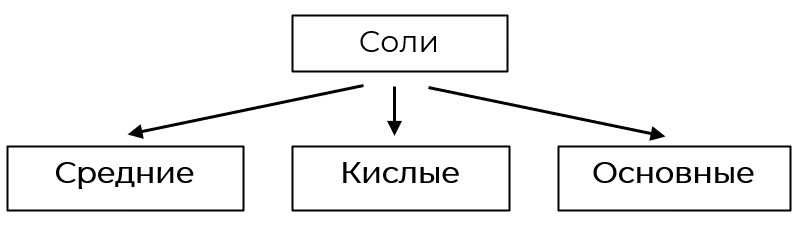
- Классификация солей по составу
- Химические свойства средних (нормальных) солей
- обобщить и систематизировать знания о классификации солей
- изучить химические свойства средних (нормальных) солей
- Какие вещества называются солями?
- Назовите общую формулу солей.
- Какие бывают соли?
Соли представляют собой один из самых обширных классов неорганических соединений. Соли проникают во все сферы человеческой деятельности и знать их химические свойства не менее важно, чем свойства других классов.
Классификация солей по составу
|
Средние
|
Кислые
|
Основные
|
|
Это продукты полного замещения атомов водорода в кислоте на металл:
— фосфат натрия; — сульфат калия.
|
Это продукты неполного замещения атомов водорода в кислоте на металл:
— дигидрофосфат натрия; — гидросульфат калия.
|
Это продукты неполного замещения гидроксогрупп в основании на кислотный остаток:
— гидроксохлорид магния; — гидроксокарбонат меди (II).
|
Химические свойства
1. Соль + кислота = новая соль + новая кислота
Кислота, вступающая в реакцию, должна быть сильнее, чем та кислота, которая образуется в результате реакции:
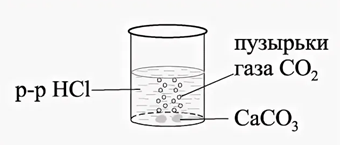 Рис. 1. Реакция взаимодействия мела с соляной кислотой
Рис. 1. Реакция взаимодействия мела с соляной кислотой
2. Соль + растворимое основание (щелочь) = новая соль + новое основание
Реакция идёт, если выпадает осадок.
|
 Рис. 2. Осадок гидроксида
Рис. 2. Осадок гидроксида железа (III) |
3. Соль + соль = новая соль 1 + новая соль 2
Взаимодействие двух солей возможно только в том случае, если обе исходные соли растворимы в воде и хотя бы один из продуктов реакции выпадает в осадок.
4. Соль + металл = новый металл + новая соль
Реакция идёт, если металл активнее, чем тот, который входит в состав соли.
Рассмотрим опыт. В стакан с раствором медного купороса опускается железный гвоздь. Через некоторое время мы увидим, что железный гвоздь покрылся слоем меди.
Я известно с давних пор
|
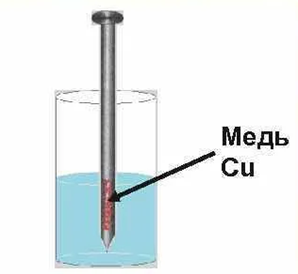 Рис. 3. Осаждение меди
Рис. 3. Осаждение меди
|
Объяснение: реакция происходит только в том случае, если металл, реагирующий с солью, был более активен, чем металл, входящий в состав соли. Сравнить активность металлов между собой можно по их положению в ряду активности. Чем левее расположен металл в этом ряду, тем у него большая способность вытеснить другой металл из раствора соли.
5. Разложение кислородсодержащих солей
Пример 1
Формула соли: а) ; б) ; в) .
Решение:
Соли — сложные вещества, состоящие из металла и кислотного остатка, формула соли — б) .
Пример 2
С каким из соединений будет взаимодействовать : а) ;
б) ; в) ?
Решение:
Из указанного списка соль будет реагировать с кислотой б) с образованием нерастворимого осадка .
Пример 3
Допишите уравнение реакции
Решение
- В реакцию вступают два сложных вещества, значит это реакция обмена.
- Дописываем уравнение, зная, что при взаимодействии соли и гидроксида образуются новая соль и новый гидроксид:
- В реакциях обмена обязательным условием является образование газа, воды или нерастворимого соединения (осадка). Проверяем полученные соединения по таблице растворимости и видим, что гидроксид меди - нерастворимое соединение, выпадает в осадок, значит реакция протекает. Уравниваем реакцию с помощью коэффициентов:
Упражнение
- Формула соли: а) ; б) ; в) .
- С каким из соединений будет взаимодействовать : а) ; б) ; в) ?
- Закончите реакцию взаимодействия
Контрольные вопросы
- К какому типу реакций относятся реакции между солями и сложными веществами?
- К какому типу реакций относятся реакции между солями и металлами?
- Какое вещество выпадает в осадок, если смешать растворы нитрата кальция и серной кислоты? Составьте уравнение реакции.
Упражнение
- в)
- а)

