- Оксиды, физические свойства оксидов
- Номенклатура оксидов
- Классификация оксидов
- сформировать понятие об оксидах как об одном из классов химических соединений
- изучить физические свойства и классификацию оксидов
- Что такое валентность химического элемента?
- Какое существует правило определения валентности элементов в бинарном соединении?
Оксиды, физические свойства оксидов
Все сложные вещества делятся на группы (классы).
Вещества данного класса широко распространены на нашей планете. Моря и океаны, покрывающие Землю, состоят из живительной воды — оксида водорода H2O, а безжизненные пустыни покрыты слоем песка, содержащего оксид кремния SiO2. Оксиды входят в состав многих горных пород, минералов и находят широкое практическое применение.
Оксиды это бинарные соединения, валентность кислорода в которых равна II.
В состав оксидов входят два химических элемента, один из которых кислород. Оксиды известны для всех химических элементов, встречающихся в природе, кроме гелия, неона, аргона. Общая формула оксидов ЭхOy.
Количественный состав каждого оксида определяется значениями валентности содержащихся в нём элемента (Э) и кислорода.
Так как валентность атомов кислорода в оксидах всегда равна II, а валентность атомов других элементов (Э) принимает значения от I до VIII, то состав оксидов можно выразить разными формулами.
Таблица 1. Общие формулы оксидов
|
Валентность
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
|
Общие
|
|
|
|
|
|
|
|
|
|
Примеры оксидов
|
|
|
|
|
|
|
|
|
Номенклатура оксидов
- Для элемента с постоянной валентностью название оксида складывается из:
«оксид» + название химического элемента в родительном падеже.
- Для элемента с переменной валентностью её указывают словами, а при написании — римскими цифрами в скобках после названия химического элемента:
«оксид» + название химического элемента в родительном падеже + валентность элемента.
Пример 1
Назовём оксиды.
|
Формула
|
Название
|
|
|
оксид углерода (II)
|
|
|
оксид азота (II)
|
|
|
оксид алюминия
|
|
|
оксид азота (V)
|
|
|
оксид железа (III)
|
|
|
оксид хрома (VI)
|
|
|
оксид цинка
|
|
|
оксид марганца (VII)
|
Упражнение
Дайте названия следующим оксидам:
Множество химических веществ, в том числе оксидов, имеют тривиальные названия.
Таблица 2. Тривиальные названия некоторых оксидов
|
Химическая
|
Химическое название
|
Тривиальное название
|
|
|
Оксид углерода (II)
|
Угарный газ
|
|
|
Оксид углерода (IV)
|
Углекислый газ
|
|
|
Оксид серы (IV)
|
Сернистый газ
|
|
|
Оксид алюминия
|
Глинозём
|
|
|
Оксид кальция
|
Негашеная известь
|
Классификация оксидов
1. По строению
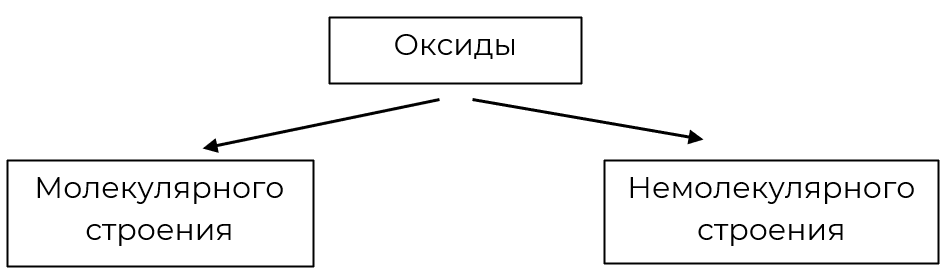
|
Молекулярного строения
|
Немолекулярного строения
|
|
Оксиды большинства неметаллов (H2O, СО, N2O3, SO3, Cl2O7 и др.), а также оксиды некоторых металлов (Mn2O7, OsO4). При комнатной температуре — это жидкие, газообразные или легкоплавкие твёрдые вещества.
|
Относятся почти все оксиды металлов, например K2O, CuO, Fe2O3, а также оксиды некоторых неметаллов, например SiO2. Как правило, это твёрдые вещества с высокими температурами плавления (т. е. являются тугоплавкими). Многие из них окрашены в различные цвета.
|
2. По агрегатному состоянию
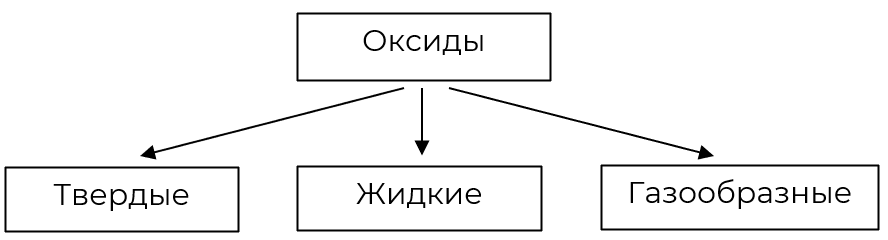
|
Твёрдые
|
Жидкие
|
Газообразные
|
|
Оксид алюминия Al2O3; песок, или оксид кремния (IV) SiO2; оксид меди (II) CuО.
|
Вода, или оксид водорода H2O; оксид марганца (VII) Mn2O7; оксид хлора (VII) Cl2O7.
|
Углекислый газ, или оксид углерода (IV) CO2; сернистый газ, или оксид серы (IV) SO2 ; оксид азота (IV) NO2.
|
Цвет оксидов может быть самым разнообразным.
Отметим, что бесцветным, например, является оксид кремния в виде кварца или горного хрусталя. Из жидких оксидов цвета не имеет вода. Большинство газообразных оксидов также не имеет окраски, но оксид азота(IV) NO2 — газообразное вещество бурого цвета.
 Рис. 1. Цвета оксидов
Рис. 1. Цвета оксидов
Оксиды содержатся в каждой из трёх оболочек нашей планеты: в атмосфере, литосфере, гидросфере.
Самым распространённым оксидом в атмосфере и гидросфере является вода H2O, а в литосфере — оксид кремния (IV) SiO2, встречающийся в виде красивых кристаллов кварца и кварцевого песка.
 Рис. 2. Оксид кремния(IV) SiO2: а — кристаллы кварца; б — кварцевый песок
Рис. 2. Оксид кремния(IV) SiO2: а — кристаллы кварца; б — кварцевый песок
Контрольные вопросы
- Какие вещества называют оксидами?
- Как классифицируют оксиды?

