- Классификация оснований
- Химические свойства оснований
- обобщить и систематизировать знания о классификации оснований
- изучить химические свойства растворимых и нерастворимых оснований
- Какие вещества называются основаниями?
- Назовите общую формулу гидроксидов.
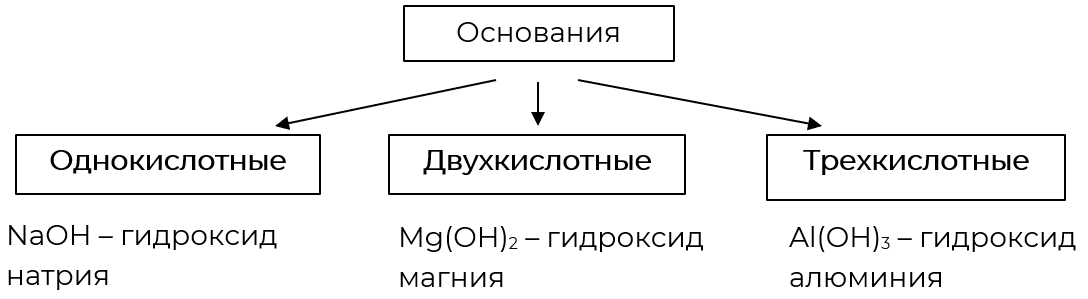
- Какие бывают основания?
Классификация оснований
Продолжаем наше знакомство с классом оснований (гидроксиды). Что, кроме названий и классификации, мы должны знать об этом классе веществ? Конечно же, свойства веществ, а также с какими классами веществ могут вступать в реакции основания.
Классификация оснований по кислотности (по количеству гидроксогрупп)
Химические свойства оснований
I. Растворимые основания, щелочи (р. о.)
- Действие индикатора
 Рис. 1. Действие индикатора в щелочной среде
Рис. 1. Действие индикатора в щелочной среде
Фактически с индикатором взаимодействуют гидроксид-ионы, содержащиеся в растворе любой щёлочи. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.
+ лакмус → синий
+ фенолфталеин → малиновый
+ метилоранж → жёлтый
- Р. о. + кислотный оксид = соль + вода
- Р. о. + кислота = соль + вода
Реакция нейтрализации — частный случай реакции обмена: при взаимодействии щелочи и кислоты образуются соль и вода.
4. Р. о. + соль = новое основание + новая соль
 Рис. 2. Образование бурого осадка гидроксида железа (III)
Рис. 2. Образование бурого осадка гидроксида железа (III)
Реакция обмена между основанием и солью возможна в том случае, если оба исходных вещества растворимы, а в результате образуется хотя бы одно нерастворимое вещество (выпадает осадок).
Выпадает бурый осадок гидроксида
железа (III).
II. Нерастворимые основания (н. о.)
- Н. о. + кислота = соль + вода
- Разложение нерастворимых оснований при нагревании
Пример 1
Вычеркните лишнее и объясните, почему это вещество вы считаете лишним в списке: КOH, NaOH, Ва(ОН)2, Fe(OH)2.
Fe(OH)2 — лишнее в списке веществ, так как согласно таблице растворимости является нерастворимым основанием.
Пример 2
Допишите уравнение реакции:
В результате взаимодействия щёлочи с растворимой солью протекает реакция обмена, сложные вещества обмениваются своими ионами, образуется новая соль и нерастворимое основание.
Упражнение
- Вычеркните лишнее и допишите напротив, почему это вещество вы считаете лишним в списке: Al(ОН)3, NaOH, Сu(ОН)2, Zn(ОН)2.
- Допишите уравнение реакции:
Контрольные вопросы
- Как по числу гидроксогрупп классифицируют основания?
- С какими соединениями могут реагировать щёлочи?
- С какими соединениями могут реагировать нерастворимые основания?
- — растворимое основание.

