- Классификация химических элементов
- Естественные семейства химических элементов
- Амфотерность
- познакомиться с классификацией химических элементов
- рассмотреть семейства химических элементов; дать понятие об амфотерных элементах
- сформировать знания о понятии «амфотерность», применение знаний о кислотно-основных свойствах соединений
Введение
Всё многообразие мира, то из чего состоит мир, нашло отражение в Периодической системе химических элементов Д. И. Менделеева (ПСХЭ).
А можно ли классифицировать химические элементы? Можно ли разобраться в их многообразии? Это задача была решена не сразу.
К 70-м годам XIX в. было известно более 60 химических элементов. Тем не менее, несмотря на наличие сходных элементов, найти единую систему, которая объединила бы все элементы, не удавалось. Различные попытки классификации были.
Классификация химических элементов
Все химические элементы делятся на металлы и неметаллы. Металлам соответствуют основные оксиды и основания, а неметаллам — кислотные оксиды и кислоты.
|
Химические элементы
|
|
|
Металлы
|
Неметаллы
|
|
Fe — железо, Al — алюминий, Hg — ртуть.
|
O — кислород, H — водород, S — сера.
|
Однако если классификации на металлы и неметаллы недостаточно, то учёные стали искать новые виды классификации.
С середины XIX века началось изучение химических элементов целыми группами, которые вскоре получили название «естественных групп», которые также называются « семействами химических элементов». Это достигалось тем, что химические элементы стали сопоставляться и сравниваться между собой. Причём в одну группу включались только элементы, химически сходные друг с другом, они резко обособлялись от всех остальных элементов как несходных с ними.
Естественные семейства химических элементов
|
Название семейства
|
Элементы данного семейства
|
Особенности данного семейства
|
|
Щелочные
|
Li, Na, K, Rb, Cs, Fr
|
|
|

|
||
|
Галогены
|
F, Cl, Br, I, At
|
|
|

|
||
|
Благородные
|
He, Ne, Ar, Kr, Xe, Rn
|
|
|

|
||
|
Щелочно-
|
Mg, Ca, Sr, Ba
|
|
|

|
||
|
Элементы
|
O, S, Se, Te
|
|
|

|
||
Амфотерность
У оксидов и гидроксидов некоторых металлов наблюдаются особые, двойственные свойства: в зависимости от природы реагента они способны проявлять и основные, и кислотные свойства.
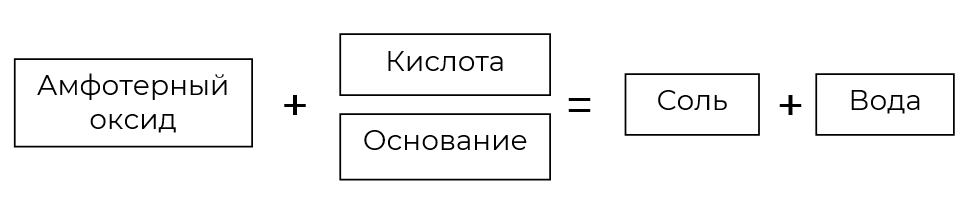
Например, — амфотерный оксид:
Амфотерность — способность соединений проявлять либо кислотные, либо основные свойства, в зависимости от того, с чем они реагируют.
Название произошло от греческого слова amphoteros, означающего «и тот, и другой».
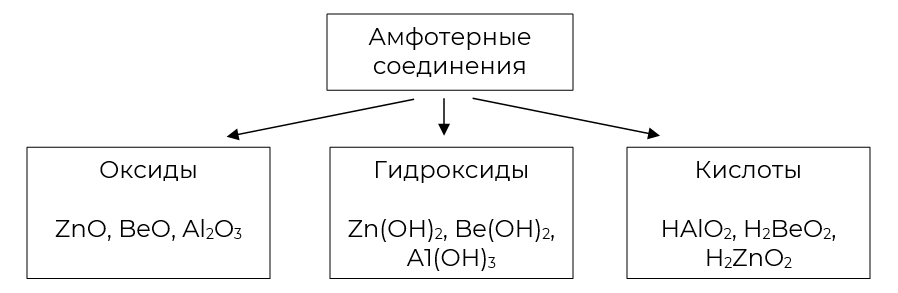
Давайте вместе составим формулу гидроксида цинка . В таком виде мы привыкли записывать основания, но это же вещество можно изобразить и в виде кислоты, достаточно раскрыть скобки и перенести водород на первое место: . Такая кислота существует, она называется цинковая, а её соли образуются с помощью кислотного остатка цинката ().
Как же распознать, что соединение является амфотерным?
Амфотерный характер носят оксиды и гидроксиды большинства переходных элементов и многих элементов побочных подгрупп.
Помните, что оксиды и гидроксиды активных металлов всегда основные.
Соединения неметаллов обычно носят кислотный характер.
Контрольные вопросы
- Сколько элементов было известно к 70-м годам XIX в.?
- На какие естественные семейства делятся химические элементы? Перечислите их.
- Что такое амфотерность? Какие элементы обладают амфотерными свойствами?

