- Кислоты
- Номенклатура кислот
- Физические свойства кислот
- Многообразие кислот
- сформировать понятие о кислотах как об одном из классов химических соединений
- изучить физические свойства и классификацию кислот
- Оксиды относятся к сложным или простым веществам?
- Как дать название оксиду?
Кислоты
Соединения этого класса в полном соответствии с его названием, характеризуются кислым вкусом. Вспомните, например, вкус лимона, обусловленный содержанием в нем лимонной кислоты. Однако распознать кислоты, с помощью рецепторов языка, запрещают правила техники безопасности. Так как же распознать кислоты?
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
Обратите внимание, что все кислоты обязательно содержат водород, который в формуле стоит на первом месте.
Номенклатура кислот
Классифицировать кислоты можно по наличию в них кислорода, также от этого зависит название кислоты:
- Бескислородные кислоты (HCl, H2S)
Чтобы составить название необходимо соблюдать последовательность: неметалл-о-водородная кислота. Например: НСl – хлороводородная кислота.
- Кислородсодержащие кислоты (HNO3, H2SiO3)
Чтобы составить название необходимо определить в какой валентности находится неметалл, отличный от водорода и кислорода:
1. Если валентность высшая: неметалл – н – ая кислота
Например, рассмотрим H2SO4 – сера в высшей валентности (VI), значит название будет звучать: серная кислота
2. Если элемент находится не в высшей и не в низшей валентности: неметалл – ист – ая кислота
Например, рассмотрим H2SO3 – сера в промежуточной валентности (IV), значит название будет звучать: сернистая кислота
Как уже было сказано выше, обязательным элементом кислоты является водород, а всю остальную часть формулы называют кислотным остатком.
Например, у НBr кислотным остатком является Br, а у Н3Р04 кислотный остаток Р04. Как правило, кислотные остатки образуют элементы – неметаллы (сера, углерод, азот, все галогены), а валентность кислотного остатка равна числу атомов водорода в кислоте.
Таблица 1. Кислородсодержащие кислоты и кислотные остатки
|
Кислота (НnА)
|
Кислотный остаток (А)
|
Валентность кислотного остатка
|
|
H2SO4 серная
|
SO4 сульфат
|
II
|
|
HNO3 азотная
|
NO3 нитрат
|
I
|
|
H2SO3 сернистая
|
SO3 сульфит
|
II
|
|
H3PO4 фосфорная
|
PO4 фосфат
|
III
|
|
HNO2 азотистая
|
NO2 нитрит
|
I
|
|
H2CO3 угольная
|
CO3 карбонат
|
II
|
|
H2SiO3 кремниевая
|
SiO3 силикат
|
II
|
Таблица 2. Бескислородные кислоты
|
Кислота (НnА)
|
Кислотный остаток (А)
|
Валентность кислотного остатка
|
|
HCl соляная (хлороводородная)
|
Cl хлорид
|
I
|
|
HBr бромоводородная
|
Br бромид
|
I
|
|
H2S сероводородная
|
S сульфид
|
II
|
|
HI иодоводородная
|
I иодид
|
I
|
|
HF плавиковая (фтороводородная)
|
F фторид
|
I
|
Физические свойства кислот
Большинство кислот - жидкие вещества. Но известны и твердые кислоты: фосфорная, метафосфорная, борная. Почти все растворимы в воде, нерастворима только кремниевая кислота H2SiO3.
Угольная и сернистая кислоты — Н2СO3 и H2SO3 — в свободном виде не существуют, очень слабые, они разлагаются на воду и соответствующий оксид (газ):
,
.
 Рис.1. Кислоты: а — азотная; б — осадок кремниевой кислоты; в — фосфорная кислота
Рис.1. Кислоты: а — азотная; б — осадок кремниевой кислоты; в — фосфорная кислота
Давайте вспомним вкус лимона, какой он? Кислый, за счет находящейся в его составе лимонной кислоты. Все кислоты кислые на вкус, но не все кислоты можно пробовать на вкус, так как многие из них ядовиты и опасны: серной кислотой можно получить ожоги; один полный вдох паров синильной кислоты (HCN) приводит к потере сознания и смерти через 1-2 минуты. Поэтому распознать концентрированные кислоты на вкус не решится ни один химик – это опасно.
Как же можно распознать кислоты, не пробуя их на вкус? Их растворы дают кислую среду, которую можно определить с помощью специальных «химических рецепторов» – индикаторов. В зависимости от среды они меняют цвет.
Индикатор — вещество, дающее цветные химические реакции в зависимости от среды раствора (например лакмус, метилоранж, фенолфталеин).
|
Индикатор
|
Лакмус
|
Метилоранж
|
Фенолфталеин
|
|
Кислая среда
|
Красный
|
Розовый
|
Бесцветный
|
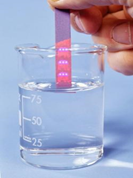
А вот кремниевую кислоту H2Si03, поскольку она нерастворима в воде, так распознавать нельзя.
Шкала, характеризующая среду раствора, называется pH (пэ-аш). Она определяется концентрацией ионов водорода в растворе: чем pН больше, тем меньше ионов водорода содержит раствор. Нейтральная среда раствора имеет pH = 7, щелочная pH > 7, кислая < 7.
 Рис.2. Шкала pH и окраска универсального индикатора в различных средах.
Рис.2. Шкала pH и окраска универсального индикатора в различных средах.
Многообразие кислот
В природе встречается множество кислот: лимонная кислота в лимонах, яблочная кислота в яблоках, щавелевая кислота в листьях щавеля. Муравьи защищаются от врагов, разбрызгивая едкие капельки, содержащие муравьиную кислоту. Она же содержится в пчелином яде и в жгучих волосках крапивы.
 Рис.3. Кислоты в природе: а – лимонная; б – яблочная; в – бензойная; г – муравьиная.
Рис.3. Кислоты в природе: а – лимонная; б – яблочная; в – бензойная; г – муравьиная.
При скисании виноградного сока получается уксусная кислота (СН3СООН), а при скисании молока — молочная кислота. Та же самая молочная кислота образуется при квашении капусты и при силосовании кормов для скота.
Многие кислоты нужны в народном хозяйстве в огромных количествах, производство этих веществ называют много тоннажным. К их числу относят серную и соляную кислоты.
Серная кислота H2SO4 — бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды. Серная кислота поглощает влагу из воздуха и других газов. Это свойство серной кислоты используют для осушения веществ.
Серная кислота одна из самых опасных, так как обугливает древесину, кожу, ткани.
 Рис.4. Концентрированная серная кислота обугливает сахар
Рис.4. Концентрированная серная кислота обугливает сахар
При смешивании серной кислоты с водой выделяется большое количество теплоты. Если воду вливать в серную кислоту, то вода, не успев смешаться с кислотой, может закипеть и выбросить брызги серной кислоты на руки и лицо работающего. Чтобы этого не случилось, при растворении серной кислоты нужно вливать ее тонкой струей в воду и постоянно перемешивать.
 Рис.5. Разбавление концентрированной серной кислоты водой.
Рис.5. Разбавление концентрированной серной кислоты водой.
Соляная кислота (HCl) – входит в состав желудочного сока человека, выполняет ряд важных функций: убивает бактерии, попадающие в желудок вместе с пищей, и помогает переваривать пищу. Желудок готовится к приёму пищи заранее: лишь только мы начинаем жевать пищу, он выделяет желудочный сок, содержащий соляную кислоту. Вот почему так вредно жевать жевательную резинку на голодный желудок, так как сок начнёт переваривать стенки самого желудка.
 Рис.6. Действие соляной кислоты на желудок.
Рис.6. Действие соляной кислоты на желудок.
Контрольные вопросы
- Какие вещества называют кислотами? Какими физическими свойствами они обладают?
- Как классифицируют кислоты?
- Как можно распознать кислоты?

