- Вода
- Свойства воды физические и химические
- Основания
- Номенклатура оснований
- Физические свойства оснований
- Классификация оснований
- Многообразие оснований
- систематизировать знания о воде и её свойствах
- сформировать понятие о классе веществ «Основания»
- изучить физические свойства и классификацию оснований
Химия — это наука, позволяющая узнать свойства веществ. Замечали вы когда-либо, что у воды есть привкус? И для каждого человека он своеобразный.
А может вы помните, что на глобусе больший объём занимает синий цвет? Это же тоже вода!
И ледники, и моря, и подземные воды представляют собой химически не связанную воду.
Вода
Гидросфера — водная оболочка земли, которая состоит на 96,5 % из вод Мирового океана, а на 3,5 % из материковых вод, которые включают в себя 1,7 % из льдов и постоянных снегов, а также на 1,7 % из жидких вод: рек, озёр, болот и подземных источников.
Но вода существует в трёх состояниях! Значит, в атмосфере она тоже есть, в виде пара.
Что же связывает Мировой океан и сушу? Круговорот воды.
 Рис. 1. Круговорот воды в природе
Рис. 1. Круговорот воды в природе
Физические свойства воды
Вода — это оксид, который может существовать в трёх агрегатных состояниях. Чистая (дистиллированная) вода представляет собой прозрачную бесцветную жидкость, которая кипит при температуре 100 °С и замерзает при температуре
0 °С.
Вода — это одно из исключений, так как все жидкости достаточно равномерно расширяются с повышением температуры. Вода же расширяется только при нагревании свыше 4 °С. В диапазоне температур от 0 до 4 °С вода сжимается, а её объём уменьшается, в связи с этим её плотность увеличивается.
Химические свойства воды
Вода — хороший растворитель. При взаимодействии с оксидами неметаллов образуются кислоты:
Оксид Фосфорная
фосфора (V) Кислота
А вот с металлами вода образует отдельный класс соединений — основания (гидроксиды). Особенно важны здесь металлы IА и IIА группы. С ними образуются растворимые гидроксиды, при этом выделяется большое количество теплоты:
Оксид Гидроксид
калия калия
Основания
Знаете ли вы, чем мыли волосы женщины в Древней Руси? Раствором золы. А рецепт был такой: взять ковш золы, да не простой, а еловой или от подсолнечника, замочить в дубовом ведре ключевой или дождевой водой. Постоит такая смесь сутки, потом её надо процедить или просто слить верхний слой, развести фильтрат чистой водой, подогреть на камельке в рубленой бане и вымыть косы. И волосы от такой смеси были крепкими, густыми.
Полученный раствор, мыльный на ощупь, — это средство под названием «щёлок». А вспомнили мы о нём сегодня потому, что реакция среды раствора щёлока такая же, как и растворов веществ, которые мы будем изучать, — оснований.
Общую формулу оснований можно записать в виде М(ОН)n, где М – это металл, а n — валентность металла.
Основания — это сложные вещества, состоящие из ионов металла и одной или нескольких гидроксогрупп.
Гидроксогруппа — это сложный ион, или гидроксид-ион (ОН) с валентностью I.
Номенклатура оснований
Основания, как и кислородсодержащие кислоты, построены не двумя, а тремя химическими элементами и обязательно содержат атомы водорода и кислорода в составе гидроксогруппы.
Чтобы дать название основанию, необходимо слово "гидроксид" соединить с названием металла в родительном падеже + (римская цифра, обозначающая числовое значение валентности металла для металлов с переменной степенью окисления).
Например:
— гидроксид натрия;
— гидроксид меди (II);
— гидроксид алюминия.
Физические свойства оснований
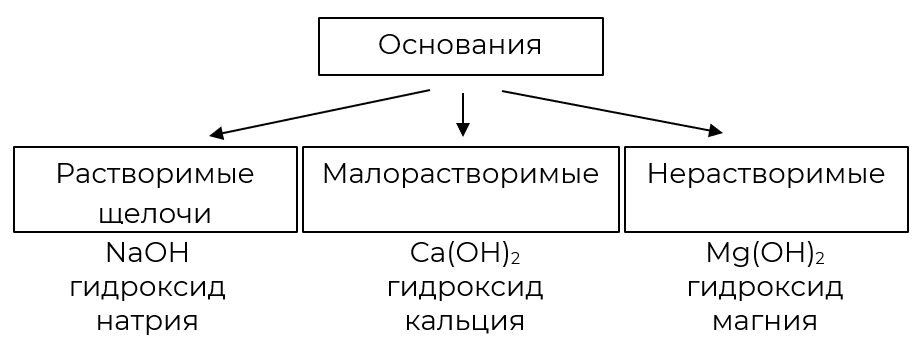
Основания — это твердые вещества. Растворимые в воде основания называются щелочами. Однако большинство оснований в воде не растворяются.
Твёрдые щелочи очень гигроскопичны. Хранить их следует в ёмкостях из полиэтилена или в толстостенных широкогорлых стеклянных банках.
Щёлочи — едкие вещества. Они разъедают кожу и ткани. Поэтому технические названия некоторых из них указывают на это свойство.
Например: NаОН — едкий натр, КОН — едкое кали. Обращаться со щелочами нужно очень осторожно.
При попадании щелочи на кожу необходимо промыть пораненное место обильной струей воды. Щелочь смывается плохо, промывание должно быть продолжительным (10–15 мин) и тщательным.
При попадании щелочи в глаза их необходимо тщательно промыть 0,2 % раствором борной кислоты.
 Рис. 2. Основания: гидроксид лития LiOH; гидроксид меди (II) Cu(OH)2; гидроксид никеля (II) Ni(OH)2;
Рис. 2. Основания: гидроксид лития LiOH; гидроксид меди (II) Cu(OH)2; гидроксид никеля (II) Ni(OH)2; гидроксид железа (III) Fe(OH)3
Классификация оснований
По растворимости
Как можно распознать растворы щелочей от растворов других веществ? Для определения растворов, которые внешне сходны с водой, необходимо использовать индикаторы.
Изменение окраски индикаторов
|

|
Многообразие оснований
|
Основание
|
Тривиальное название
|
Применение
|
Демонстрация
|
|
Гидроксид натрия
|
Едкая щелочная соль, каустик, каустическая сода — так называли в разные времена в России гидроксид натрия. До сих про сохранилось его старое название «едкий натр», предложенное ещё в 1807 году русским химиком Александром Ивановичем Шерером.
|
В мыловарении, кожевенной промышленности, в производстве бумаги, картона, искусственных волокон. Используется как основной компонент средств для устранения засоров канализационных труб.
|

|
|
Гидроксид калия
|
Едкое кали
|
Используется при «варке» тугоплавкого стекла, производстве бумаги, жидкого мыла.
|

|
|
Гидроксид кальция
|
В технической литературе и в быту часто встречаются такие названия веществ: гашёная известь, известковое молоко, известковая вода.
Прозрачный раствор Са(ОН)2 — известковая вода.
|
В строительстве при кладке и штукатурке стен, для побелки деревьев, для получения хлорной извести, которая является дезинфицирующим средством. Используется для распознавания углекислого газа.
|
 Помутнение известковой воды — качественная реакция на углекислый газ
Помутнение известковой воды — качественная реакция на углекислый газ
|
Контрольные вопросы
- Каков состав оснований?
- Как составить формулу основания по названию?
- Как классифицируются основания?
- Как отличить растворы щелочей от растворов других веществ?

