- Определение окислительно-восстановительных реакций
- Окислитель и восстановитель
- Метод электронного баланса для составления ОВР
- сформировать знания о понятиях «окислительно-восстановительная реакция», «окислитель», «восстановитель»
- научиться составлять электронный баланс
- закрепить умения определять степени окисления химических элементов, расставлять коэффициенты в уравнениях химических реакций
- Что такое электроотрицательность?
- Что такое степень окисления?
- Может ли степень окисления элемента быть равной нулю? В каких случаях?
Определение окислительно-восстановительных реакций
Многообразие классификаций химических реакций по различным признакам (выделение или поглощение теплоты, использование катализатора) можно дополнить ещё одним признаком. Этот признак — изменение степени окисления атомов химических элементов, образующих реагенты и продукты реакции.
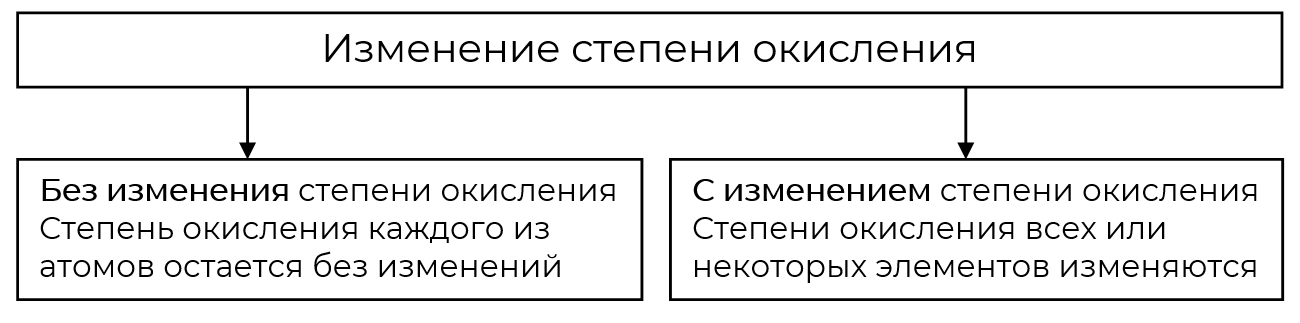
Окислительно-восстановительные реакции (ОВР) — это реакции, в которых происходит изменение степеней окисления атомов элементов.
Окислитель и восстановитель
В ОВР происходит переход электронов от одних атомов к другим, одновременно протекают два противоположных процесса: окисление и восстановление.
Шкала изменения степени окисления элементов
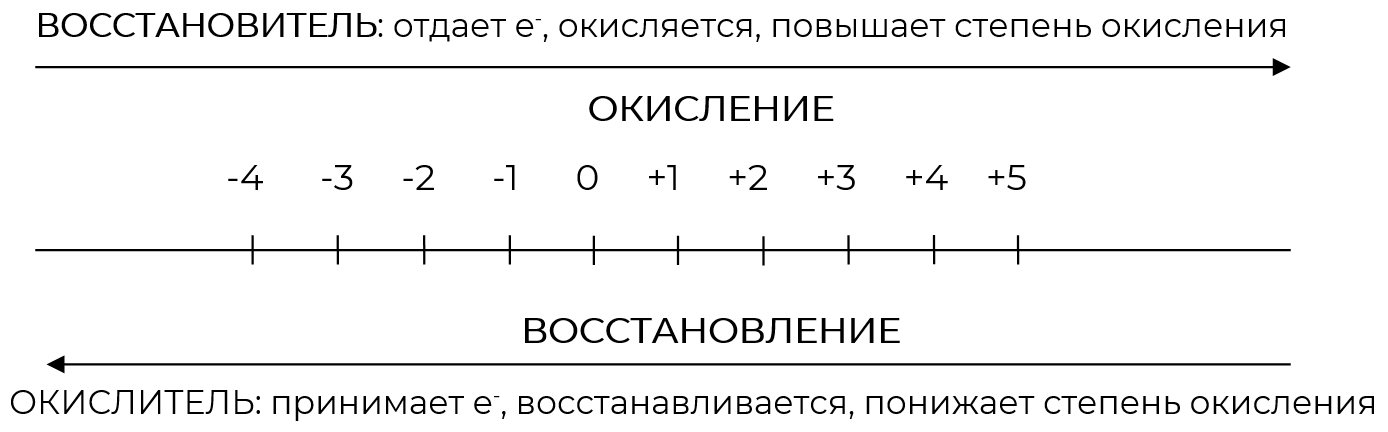
Окисление — процесс отдачи электронов.
Элемент, отдающий электроны, — восстановитель .
Восстановление — процесс принятия электронов.
Элемент, принимающий электроны, — окислитель .
При протекании ОВР степень окисления восстановителя повышается, а степень окисления окислителя понижается.
Пример 1
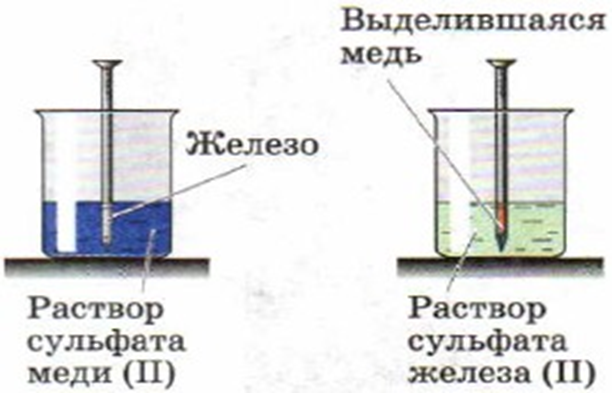
В качестве примера ОВР рассмотрим следующий опыт:
В пробирку нальём 4–5 мл раствора сульфата меди (II) и опустим в неё железный гвоздь. Оставим пробирку в штативе на 1–2 мин. При наблюдении легко заметить, что в результате реакции гвоздь покрылся красноватым налётом свободной меди:
В этой реакции элементы железо и медь меняют свои степени окисления:
.
Следовательно, эта реакция является окислительно-восстановительной.
Атомы железа в степени окисления 0 отдали два электрона, превратившись при этом в ион с зарядом +2: — процесс окисления.
Ионы меди в исходном веществе имели степень окисления +2, а в продукте реакции — степень окисления 0, т. е. каждый из них принял по два электрона: — процесс восстановления.
Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов: окисления и восстановления. В этих реакциях число электронов, отдаваемых восстановителями, равно числу электронов, присоединяемых окислителями.
Метод электронного баланса для составления ОВР
Рассмотрим составление уравнений окислительно-восстановительных реакций методом электронного баланса. В основе метода лежит правило: общее число электронов, которые отдаёт восстановитель, всегда равно общему числу электронов, которые присоединяет окислитель.
Алгоритм составления химических уравнений методом электронного баланса:
- Запишите схему уравнения химической реакции.
- Расставьте степени окисления всех элементов в соединениях.
Памятка
Степень окисления атома обозначают знаком заряда и цифрой над символом химического элемента в формуле вещества, например: . Причём, в отличие от заряда иона, у степени окисления сначала пишут знак, а затем цифру.- Степень окисления свободных атомов и атомов в простых веществах равна нулю. Например: .
- Сумма степеней окисления всех атомов в молекуле (или формульной единице) вещества равна нулю: .
- Существуют атомы химических элементов, которые в сложных веществах проявляют единственно возможную степень окисления. К ним относятся , многие металлы ( и др.).
В большинстве соединений атомы водорода и кислорода проявляют степени окисления соответственно +1 и –2 ().
- Степень окисления свободных атомов и атомов в простых веществах равна нулю. Например: .
- Составьте электронный баланс, укажите окислитель и восстановитель, процессы окисления и восстановления.
- Перенесите дополнительные множители как коэффициенты и уравняйте уравнение химической реакции.
Пример 2
Запишем схему уравнения химической реакции:
.
Расставим степени окисления всех элементов в соединении и определим, атомы каких элементов изменяют степень окисления:
.
Составим электронный баланс уравнений процессов окисления и восстановления.
Если простое вещество в уравнении реакции представляет собой двухатомную молекулу, мы переписываем его в таком же виде в электронный баланс, удваиваем количество отданных/принятых электронов, а также уравниваем схему, расставляя коэффициенты:
— процесс окисления,
— процесс восстановления,
— восстановитель, — окислитель.
Подберём общее делимое для отданных и принятых е и коэффициенты для электронных уравнений:
— процесс окисления, элемент — восстановитель;
— процесс восстановления, элемент — окислитель.
Перенесём эти коэффициенты в уравнение ОВР и подберём коэффициенты перед формулами других веществ:
Упражнение
- Составьте электронный баланс и расставьте коэффициенты в схеме реакции:
- Определите, какая из предложенных реакций не является ОВР:
Контрольные вопросы
- Как называется процесс принятия электронов?
- Как называются атомы, ионы или молекулы, принимающие электроны?
- Окислителем или восстановителем является алюминий в реакции:
?

