- Строение карбоновых кислот. Номенклатура. Изомерия
- Физические свойства карбоновых кислот
- Химические свойства карбоновых кислот
- Получение карбоновых кислот
- Применение применение карбоновых кислот
- рассмотреть особенности строения карбоновых кислот
- научиться составлять структурные формулы карбоновых кислот, давать им названия
- научиться составлять уравнения химических реакций с участием карбоновых кислот
- рассмотреть основные способы получения карбоновых кислот
- рассмотреть применение важнейших карбоновых кислот
- В какие вещества окисляются альдегиды?
- Между какими веществами протекает реакция этерификации?
- У каких органических веществ наблюдаются кислотные свойства?
- Назовите характерные реакции для неорганических кислот.
Строение карбоновых кислот. Номенклатура. Изомерия
Карбоновые кислоты относятся к кислородсодержащим органическим веществам, в молекуле которых имеется особая карбоксильная группа.
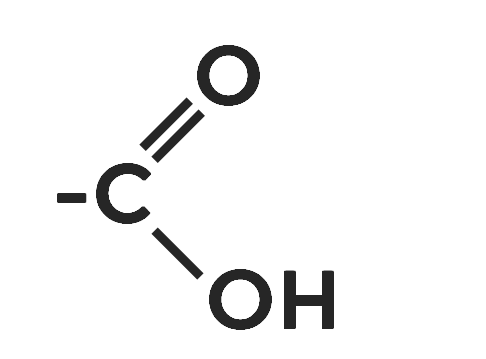
Часто её записывают как . Карбоксильных групп в составе может быть несколько. Это будут двух и трёхосновные кислоты.
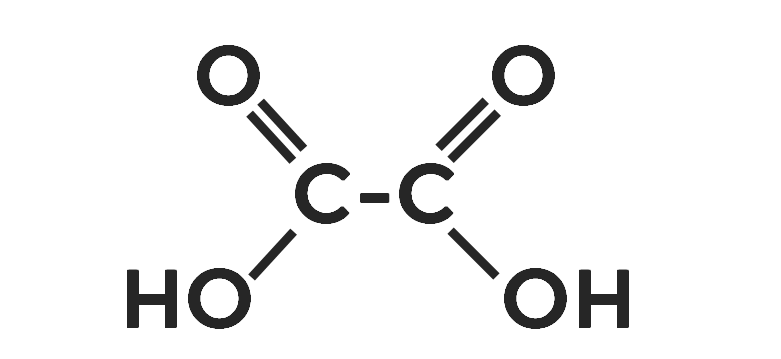
Например двухосновая — щавелевая кислота.
Кроме этого, есть различные непредельные карбоновые кислоты, например олеиновая, входящая в состав жиров:
.
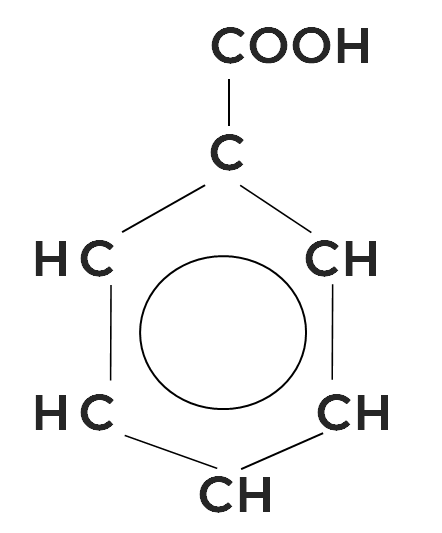
Кислоты могут быть также ароматическими. Самая известная — бензойная кислота.
Мы подробнее рассмотрим одноосновные карбоновые кислоты с одной карбоксильной группой.
Названия карбоновых кислот происходят от названий алканов, только в конце к ним добавляется суффикс «овая».
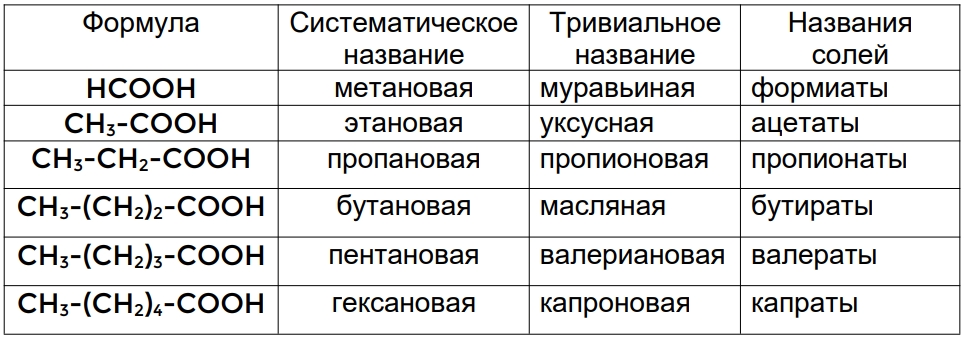
Соответственно, они будут называться: метановая, этановая, пропановая и т. д. Помимо названий по систематической номенклатуре у многих карбоновых кислот есть ещё и тривиальные названия, некоторые из которых приведены в таблице 1.
Таблица 1. Номенклатура карбоновых кислот и солей
Общая формула карбоновых кислот Ту же общую формулу имеют сложные эфиры, которые мы рассмотрим на следующем занятии.
Упражнение 1
Составьте сокращённые структурные формулы: 2 -метилпропановая кислота, 2-метилбутановая кислота, 2,3-диметилбутановая кислота.
Физические свойства карбоновых кислот
По агрегатному состоянию карбоновые кислоты являются либо жидкостями, либо твёрдыми веществами. Между молекулами они также, как и спирты, образуют водородные связи, поэтому хорошо растворимы в воде. Растворимость в воде уменьшается с увеличением углеводородного радикала.
Химические свойства карбоновых кислот
Кислотные свойства
Карбоновые кислоты, как и неорганические кислоты, являются электролитами, правда, очень слабыми. Поэтому они диссоциируют обратимо:
.
Это определяет их свойства, которые являются аналогичными по сравнению с неорганическими кислотами, только выражены слабее.
Они также реагируют с металлами, которые расположены в ряду активности до водорода:
.
муравьиная формиат магния
кислота
Вступают в реакции нейтрализации с основаниями:
.
уксусная ацетат калия
кислота
Реагируют с амфотерными гидроксидами:
.
уксусная ацетат цинка
кислота
Взаимодействуют с основными и амфотерными оксидами металлов:
.
уксусная ацетат меди
кислота
.
уксусная ацетат цинка
кислота
Карбоновые кислоты являются слабыми, но даже они вытесняют более слабые кислоты из солей, например, угольную (в первой реакции) или сернистую кислоты (во второй реакции):
,
муравьиная формиат натрия
кислота
.
уксусная ацетат натрия
кислота
Реакция этерификации (образование сложных эфиров)
Как вы помните, карбоновые кислоты со спиртами образуют сложные эфиры. Реакция обратима, протекает при высокой температуре и под действием катализаторов. Чаще всего используется концентрированная серная кислота как водоотнимающее средство. Схематически уравнение реакции этерификации выглядит следующим образом.
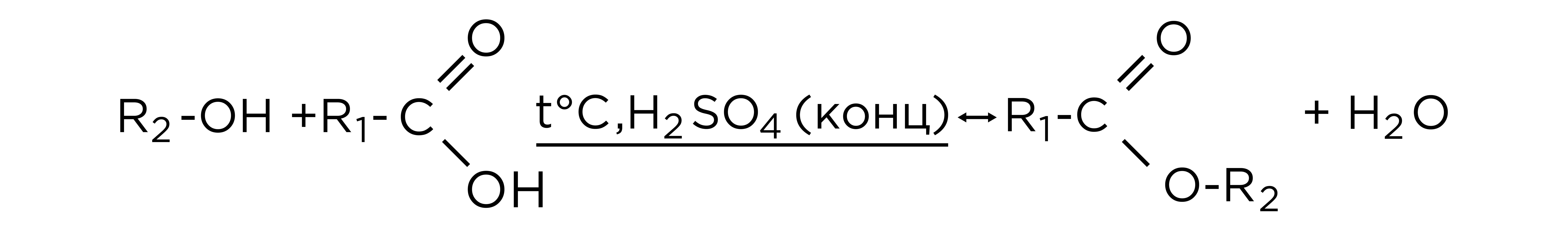
Со сложными эфирами, образованными в ходе химического процесса, вы подробнее познакомитесь в нашей следующей теме.
Специфические свойства муравьиной кислоты
Муравьиная кислота содержит в своём составе две группы: альдегидную и карбоксильную. Поэтому она как альдегид будет вступать в реакции окисления, например с аммиачным раствором оксида серебра или гидроксидом меди (II) при нагревании.
Получение карбоновых кислот
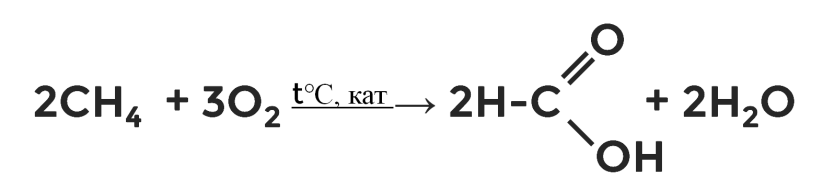
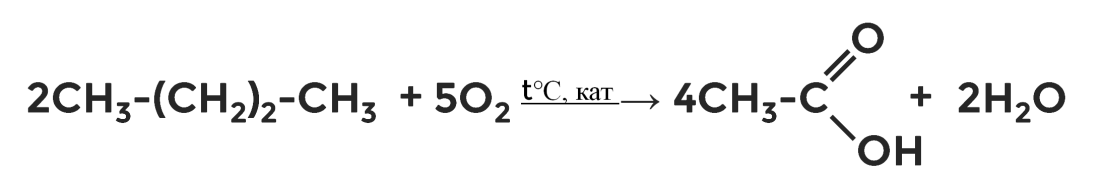
Окисление алканов
Карбоновые кислоты можно получить окислением некоторых алканов. Реакции идут при высокой температуре и в присутствии катализаторов. Так, в промышленности получают муравьиную кислоту из метана и уксусную из бутана.
Окисление альдегидов и спиртов
Карбоновые кислоты, как вы помните, можно получить окислением альдегидов. Например, гидроксидом меди (II) при нагревании этаналя получаем уксусную кислоту.
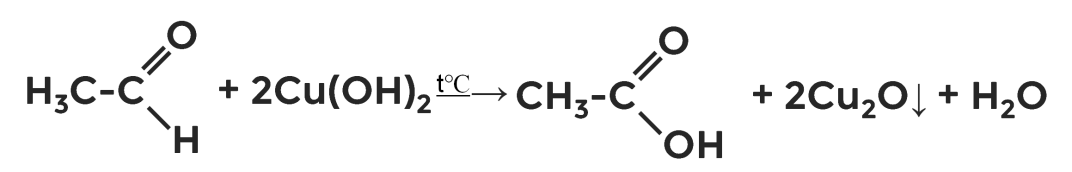
Вы знаете также, что спирты окисляются в альдегиды, поэтому карбоновые кислоты возможно получать прямым окислением спиртов. Схематически эту реакцию можно представить так:
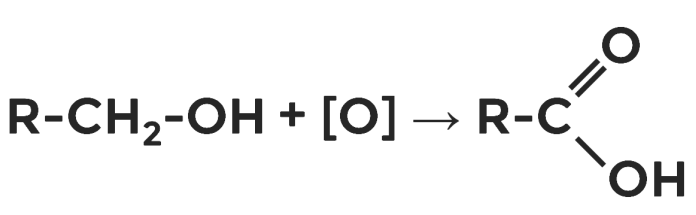
Применение карбоновых кислот
Карбоновые кислоты встречаются повсеместно в жизни человека.
С пищей мы получаем уксусную, яблочную, молочную, лимонную, бензойную, аскорбиновую кислоты. В качестве лекарственных препаратов применяем салициловую и ацетилсалициловую кислоты. А ещё есть высшие (жирные) карбоновые кислоты: пальмитиновая, стеариновая, олеиновая, линолевая. Все они входят в состав жиров. В дальнейшем мы рассмотрим этот вопрос подробнее. Муравьиная встречается в крапиве и муравьях. Из уксусной кислоты изготавливают волокна. Уксусную эссенцию, то есть её 70–80%-й раствор, применяют в пищевой промышленности для консервирования продуктов питания.
Упражнение 2
Вам выдали три пробирки с неподписанными веществами: уксусная кислота, этаналь, этиленгликоль. Имея в распоряжении свежеприготовленный гидроксид меди (II), составьте алгоритм определения веществ. Составьте уравнения химических реакций.
Упражнение 3
Закончите уравнения химических реакций.
Контрольные вопросы
1. В чём особенности строения карбоновых кислот?
2. Какие химические свойства характерны для карбоновых кислот? Что называют реакциями этерификации?
3. Назовите способы получения муравьиной и уксусной кислот.
4. Укажите области применения уксусной кислоты.
Ответы
Упражнение 1
2 -метилпропановая кислота
2-метилбутановая кислота
2,3-диметилбутановая кислота
Упражнение 2
Ко всем веществам в 3 пробирках добавляем гидроксид меди (II).
- Если осадок растворяется с образованием голубого раствора, то делаем вывод: в пробирке уксусная кислота.
- Если образуется раствор ярко-синего (василькового) цвета — это этиленгликоль.
- Осадок при нагревании становится кирпично-красным — это этаналь.
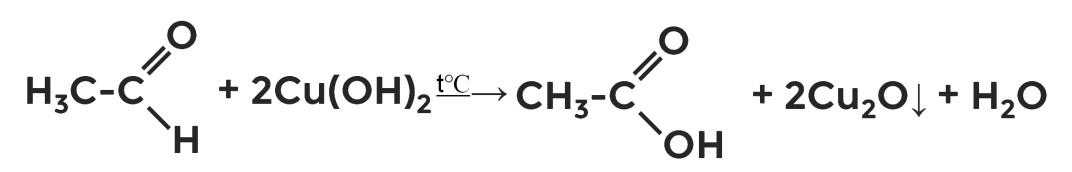
Упражнение 3
Закончите уравнения химических реакций.

