- Строение фенола. Номенклатура фенолов. История открытия
- Физические свойства фенола
- Химические свойства фенола
- Получение фенола
- Применение фенола
- рассмотреть взаимосвязь строения и свойств фенола
- рассмотреть характерные химические свойства фенола
- научиться составлять уравнения химических реакций с участием фенола
- рассмотреть основные направления применения фенола
- Сформулируйте третье положение теории строения веществ А. М. Бутлерова.
- Какие реакции характерны для спиртов? С какой функциональной группой это связано?
- Что такое бензольное кольцо? У каких веществ оно встречается?
- Какие реакции типичны для аренов? Почему?
- Где применяется глицерин?
Строение фенола. Номенклатура фенолов. История открытия
В 1834 году немецкий химик Фридлиб Фердинанд Рунге обнаружил в каменноугольной смоле белое кристаллическое вещество с характерным запахом. Состав вещества он не определил. В 1842 году Огюст Лоран определил состав вещества и дал ему название «феном». Он установил, что вещество обладает выраженными кислотными свойствами и является производным бензола (открытого незадолго до фенола). Соотечественник Лорана Шарль Фридерик Жерар полагал, что полученное вещество является спиртом и предложил называть его фенолом.
В 1867 году английский хирург Джозеф Листер написал статью о применении раствора фенола — карболовой кислоты — в качестве антисептика в хирургии.
Впоследствии было установлено, что целая группа веществ обладает подобным строением и свойствами, поэтому их начали называть «фенолами».
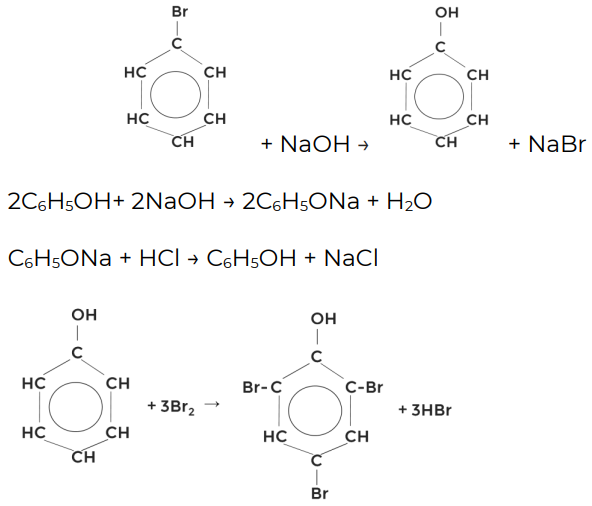
Было установлено, что фенол состоит из бензольного кольца и гидроксильной группы. Следовательно, он является производным бензола и его структурная формула будет иметь следующий вид.
Фенол неправильно считать спиртом, хотя у него и есть гидроксильная группа. Дело в том, что бензольное кольцо и OH группа влияют друг на друга. Бензольное кольцо оттягивает на себя электронную плотность от гидроксильной группы, благодаря чему на атоме водорода группы OH возникает частичный положительный заряд, что проявляется в увеличении кислотных свойств. Отрицательный заряд, смещаемый на бензольное кольцо локализуется в орто- и пара-положениях, в которых и будут проходить реакции замещения.
Фенол является родоначальником веществ, содержащих бензольное кольцо и гидроксильную группу (или несколько гидроксильных групп).
Фенолы — производные аренов, содержащие одну или несколько гидроксильных групп, соединённых с бензольном кольцом.
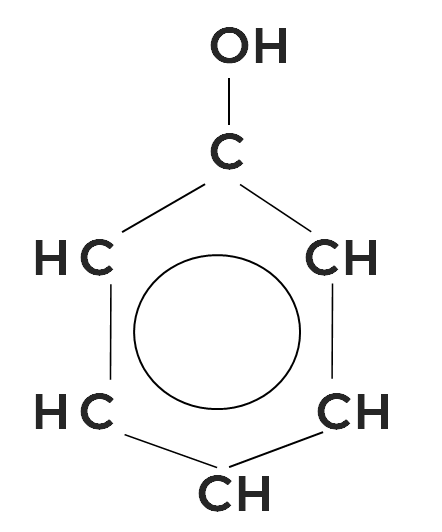
В медицине применяется 1,3-дигидроксибензол, или резорцин.
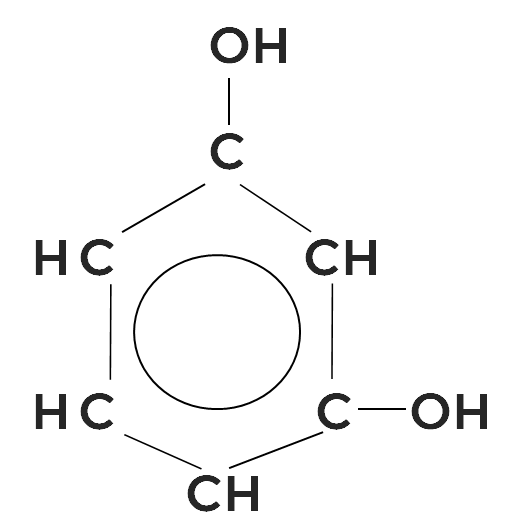
1,4-дигидроксибензол, или гидрохинон используется в фотографии и аналитической химии.
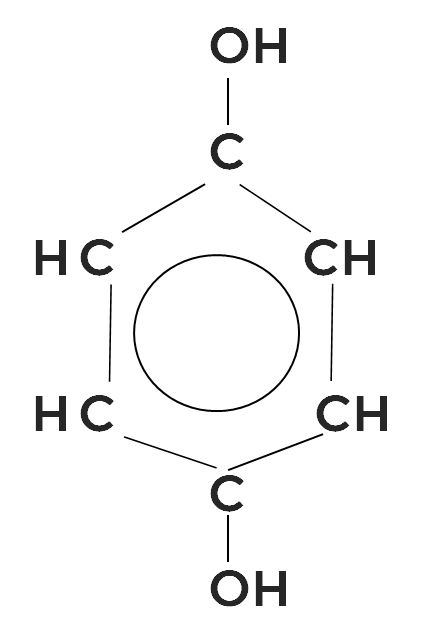
Фенолы с метильным радикалом называются крезолами. Например, орто-метилфенол, или орто-крезол.
Физические свойства фенола
 Рисунок 1. Фенол
Рисунок 1. Фенол
Фенол представляет собой бесцветные кристаллы с характерным запахом. При хранении фенол частично окисляется и приобретает розовую окраску. В холодной воде мало растворим. При взбалтывании образует суспензию. Значительно лучше растворяется в горячей воде.
При попадании на кожу вызывает ожоги. Фенол очень токсичен. Вдыхание его паров может вызвать отравление, головокружение и даже летальный исход.
Химические свойства фенола
У фенола есть гидроксильная группа и бензольное кольцо, поэтому для него будут характерны реакции замещения, протекающие по бензольному кольцу, как у аренов, а также реакции по гидроксильной группе (слабые кислотные свойства).
Кислотные свойства фенола
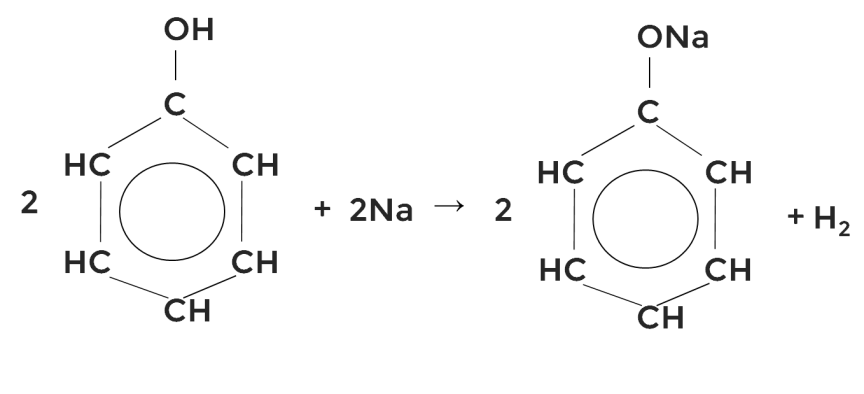
Кислотные свойства фенола выше, чем у спиртов. Не случайно поэтому раствор фенола раньше называли карболовой кислотой. Реакции идут со щелочами и щелочными металлами по гидроксильной группе, образуются феноляты калия и натрия соответственно.
или
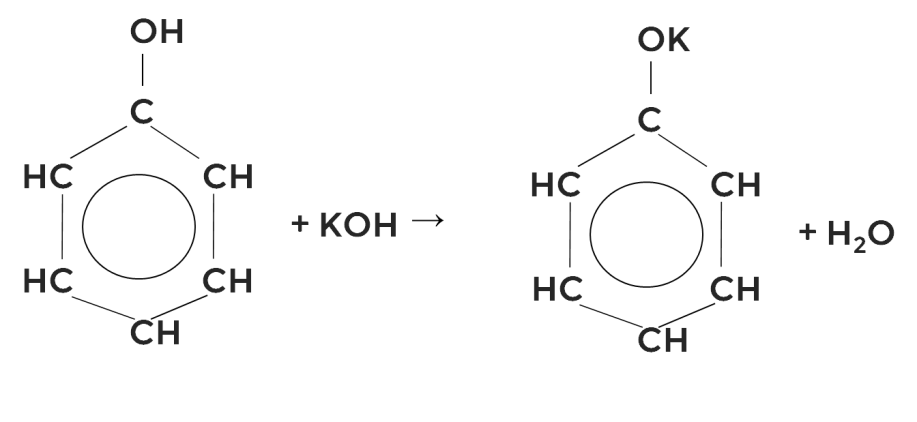
или
Хотя фенол и проявляет кислотные свойства, превосходя по этому показателю многоатомных, а тем более одноатомных спиртов, тем не менее его нельзя назвать даже средней по силе кислоте.
Он уступает даже слабой угольной кислоте которая вытесняет его из растворов солей:
.
 Рисунок 2. Раствор фенолята железа
Рисунок 2. Раствор фенолята железа
С солями железа (III) фенол образует окрашенные комплексы фенолята железа фиолетового цвета. Это качественная реакция на фенолы.
Реакции фенола по бензольному кольцу
Фенол, как и гомологи бензола, вступает в реакции замещения, которые протекают в орто- и пара-положениях.
Фенол обесцвечивает бромную воду. В результате в виде осадка белого цвета образуется 2,4,6-трибромфенол.
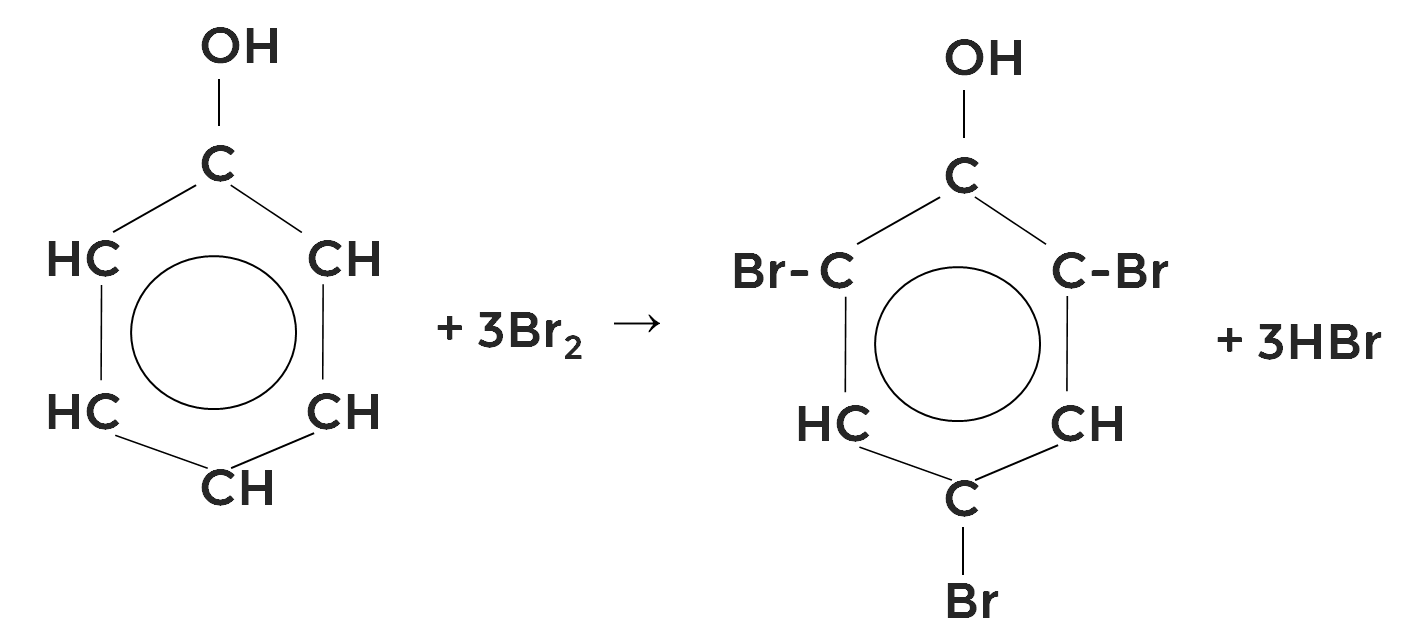
С концентрированной азотной кислотой в присутствии концентрированной серной кислоты как катализатора и под действием высокой температуры образуется 2,4,6-тринитрофенол, или пикриновая кислота.
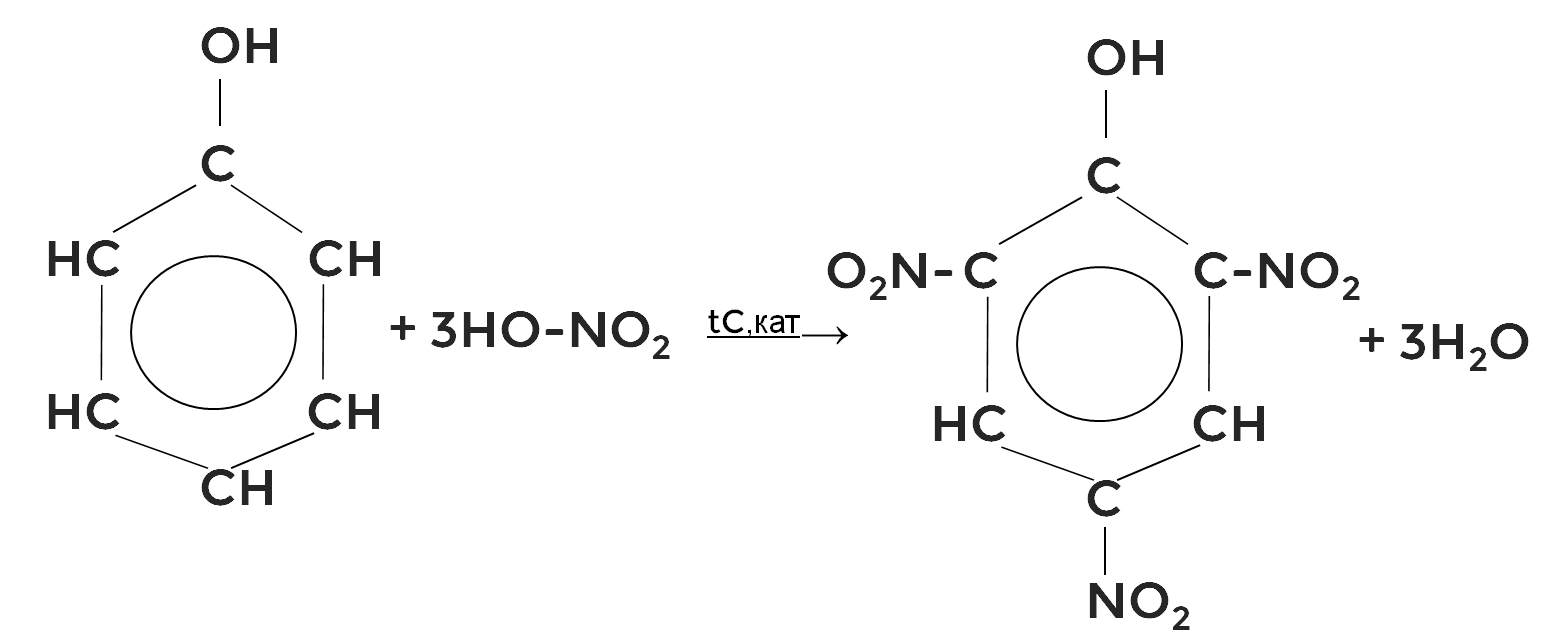
Пикриновая кислота применяется как взрывчатое вещество.
Получение фенола
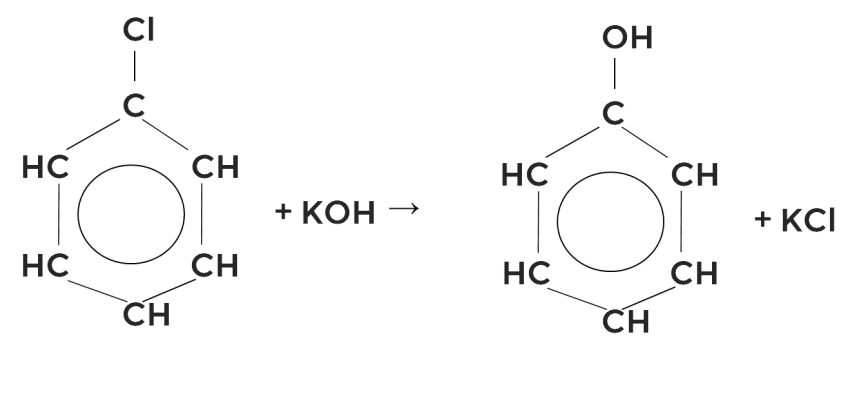
Взаимодействие галогенбензолов с водными растворами щелочей
Фенол можно получить так же как и спирты, если галогенбензол, например хлорбензол, обработать водным раствором щёлочи.
Кумольный способ получения фенола
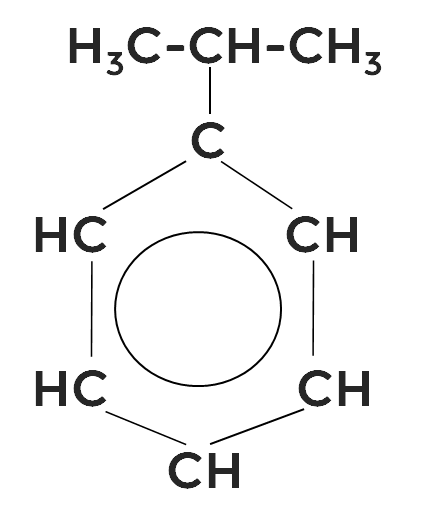
Кумол, или изопропилбензол окисляется кислородом с образованием двух ценных продуктов: фенола и ацетона.
Применение фенола
Не смотря на свою токсичность, фенол по-прежнему применяется в медицине как антисептик. Кроме этого, он входит в состав краски гуашь.
Именно фенолом пахнут эти краски.
Из фенола и формальдегида синтезируют фенолформальдегидную смолу. Она применяется для создания древесностружечных плит, сокращённо ДСП. Правда, в настоящее время многие производители отказываются от смол на основе фенола из-за его токсичности.
 Рисунок 3. Применение фенола
Рисунок 3. Применение фенола
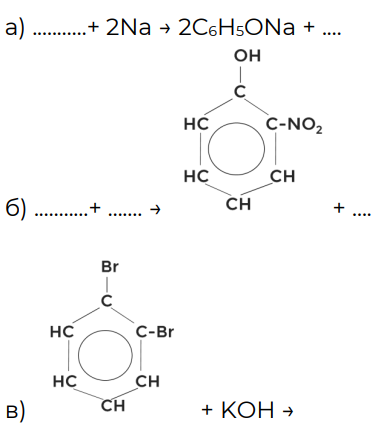
Упражнение 1
Заполните пропуски в уравнениях химических реакций.
Упражнение 2
Напишите уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
бромбензол → фенол → фенолят натрия → фенол → 2,4,6-трибромфенол.
Формулы веществ записывайте структурно.
Контрольные вопросы
- В чём особенности строения фенола по сравнению со спиртами?
- Какие химические свойства характерны для фенола? Почему?
- Объясните взаимное влияние гидроксильной группы и бензольного кольца друг на друга в молекуле фенола.
- Назовите способы получения фенола.
- Укажите области применения фенола.
- Подумайте, почему сейчас многие мебельные производители отказываются от смол на основе фенола?
Ответы
Упражнение 1
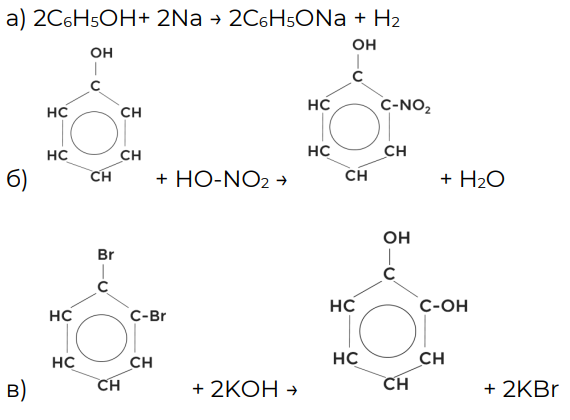
Упражнение 2
Бромбензол → фенол → фенолят натрия → фенол → 2,4,6-трибромфенол
Примерные варианты уравнений химических реакций: