- Строение предельных одноатомных спиртов. Номенклатура
- Изомерия предельных одноатомных спиртов
- Физические свойства спиртов
- Химические свойства спиртов
- Получение спиртов
- Применение спиртов
- рассмотреть взаимосвязь строения и свойств предельных одноатомных спиртов
- научиться составлять структурные формулы предельных одноатомных спиртов, давать им названия
- научиться составлять уравнения химических реакций спиртов
- рассмотреть основные направления получения и применения спиртов
- рассмотреть пагубное воздействие этанола на организм человека
- Какие свойства проявляют основания, кислоты?
- В реакциях получения алкенов вы встречали дегидратацию спиртов. Расскажите подробнее о условиях протекания данной реакции.
Строение предельных одноатомных спиртов. Номенклатура
Спирты относятся к кислородсодержащим веществам.
Предельные одноатомные спирты являются производными алканов. Вместо одного атома водорода они будут содержать гидроксильную группу Следовательно, если у предельных углеводородов алканов общая формула то у спиртов она будет
Свойства спиртов будут обусловлены наличием этой группы. Подобные группы получили название функциональные.
Функциональная группа — структурный фрагмент органической молекулы, определяющий её химические свойства.
Спирты — органические соединения, содержащие одну и несколько гидроксильных групп OH.
В молекулах спиртов происходит смещение электронной плотности от углеводородного радикала (R) на кислород и от водорода на кислород: .
Благодаря этому спирты могут проявлять как кислотные (замещение водорода), так и основные свойства (замещение группы OH).
Названия спиртов происходят от названий алканов, только к ним добавляется ещё суффикс ол (таблица 1). Нумерация углеродной цепочки делается с конца, где ближе функциональная группа OH.
Таблица 1. Номенклатура спиртов
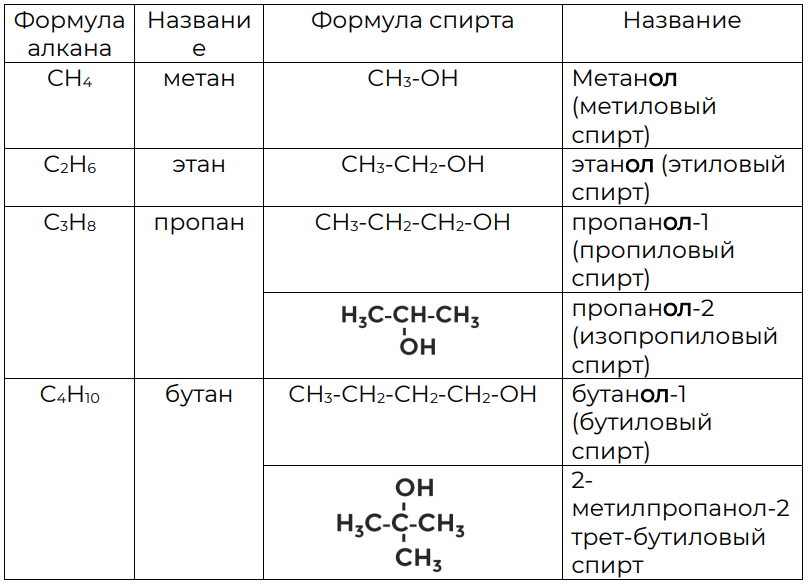
В зависимости от расположения гидроксильной группы в молекуле, спирты делятся на первичные, вторичные и третичные.
В первичных спиртах гидроксильная группа соединена с атомом углерода, который соединён с одним углеродом:
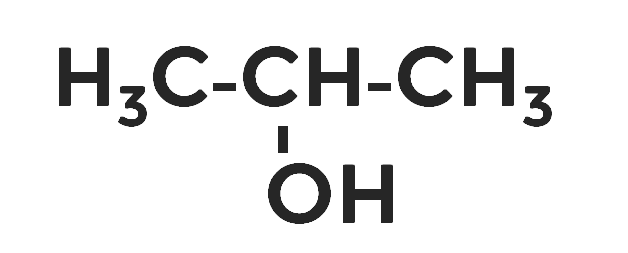
Во вторичных спиртах гидроксильная группа присоединяется к углероду, связанному с двумя атомами углерода.
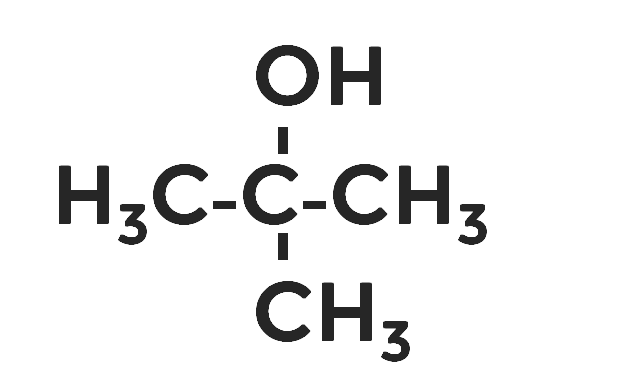
В третичных, соответственно, с тремя.
Изомерия предельных одноатомных спиртов
Для спиртов характерна изомерия углеродного скелета, как у алканов; а также изомерия положения функциональных групп и межклассовая изомерия.
В качестве изомеров углеродного скелета можно привести примеры бутанола-1 и 2-метилпропанола-1.

Изомеры положения функциональных групп представлены в таблице (таблица 1): пропанол-1, пропанол-2. Они отличаются расположением функциональной группы OH.
Такую же общую формулу, как предельные одноатомные спирты, имеют простые эфиры, поэтому они являются межклассовыми изомерами одноатомных спиртов.
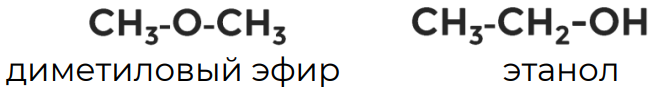
Упражнение 1
Составьте сокращённые структурные формулы 2-метилпропанола-2; 3-метилбутанола-2; 2,3-диметилбутанола-1.
Физические свойства спиртов
Спирты являются жидкими веществами хорошо растворимыми в воде. Причём это касается даже первых представителей гомологического ряда, у которых молярная масса меньше, чем у некоторых газообразных алканов. Причина в образовании особых водородных связей. Именно за счёт этих связей их молекулы ассоциируются в жидкости и хорошо растворимы в воде.
Водородные связи — это межмолекулярные (реже внутримолекулярные) химические связи между атомом водорода одной молекулы и неметаллом с высокой электроотрицательностью (F, O, N и др.) другой молекулы.
Химические свойства спиртов
Свойства спиртов, как уже было сказано, обуславливает гидроксильная группа OH. Благодаря этой группе у них будут и кислотные, и основные свойства. Правда, и те и другие очень слабые.
Кислотные свойства спиртов
Кислотные свойства спиртов слабее даже, чем кислотные свойства воды. Поэтому они не реагируют со щелочами, вступают в реакции только со щелочными металлами, которые замещают водород в гидроксильной группе:
.
Из этанола образуется этилат калия.
Реакция идёт не так бурно, как если бы калий взаимодействовал с водой:
.
Это доказывает, что кислотные свойства спиртов слабее, чем кислотные свойства воды.
Основные свойства спиртов
Основные свойства у спиртов также достаточно слабые, поэтому они вступают в реакции замещения гидроксильной группы только с самыми сильными кислотами: концентрированными растворами галогеноводородов
Из спиртов образуются галогеналканы. В нашем примере это бромэтан.
Реакция внутримолекулярной дегидратации
Вы уже знаете, что один из способов получения алкенов — это дегидратация спиртов, то есть отщепление молекулы воды. Например, из пропанола-2. В результате получаются алкены. В нашем случае — пропилен.
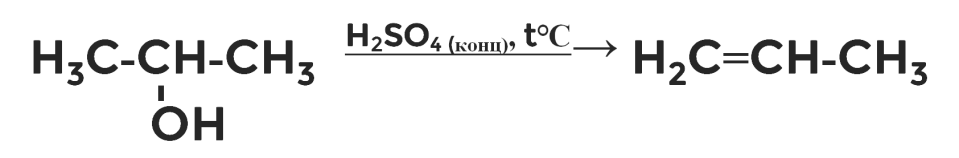
Реакции этерификации
Особый тип реакции, в результате которой из спиртов и карбоновых кислот под действием температуры в присутствии водоотнимающего средства
(катализатор — концентрированная серная кислота) образуются вещества нового класса — сложные эфиры. В нашем примере из уксусной кислоты и этанола — этилацетат.
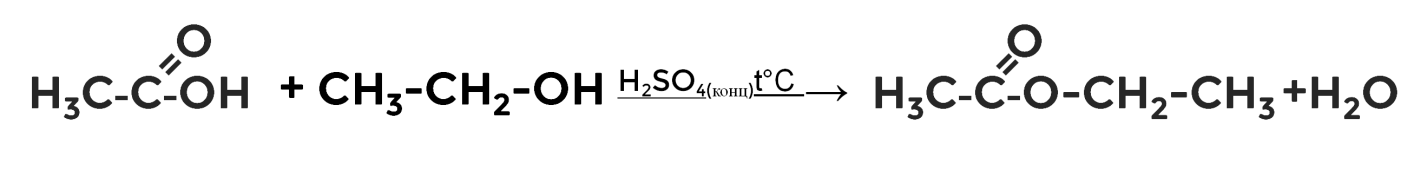
Окислительно-восстановительные реакции
Вы наверняка хорошо знаете, что спирты горят. Нагревание многих веществ в школе мы проводим с помощью спиртовки, резервуар которой заполнен спиртом этанолом:
.
Кроме этого, первичные спирты окисляются оксидом меди при нагревании в альдегиды, а вторичные в кетоны (рис. 1):
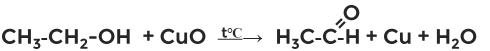
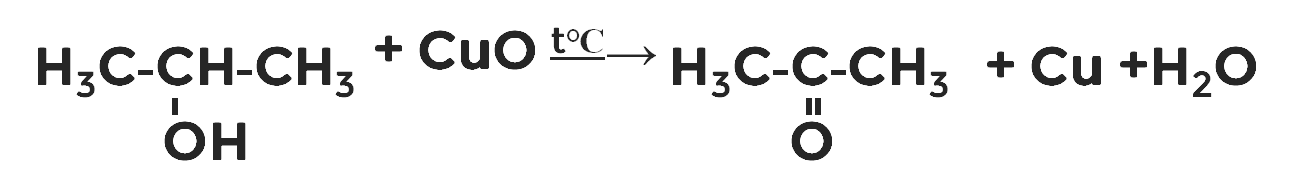
 Рисунок 1. Окисление этанола
Рисунок 1. Окисление этанолаоксидом меди (II)
Получение спиртов
1. Гидратация алкенов
Это уже знакомая вам реакция. Идёт взаимодействие алкенов с водой в кислой среде. В результате образуется спирт. Реакция протекает по правилу Марковникова.
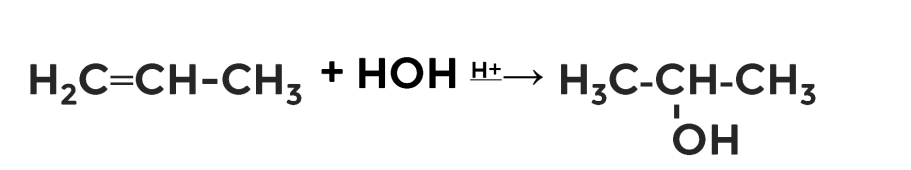
2. Взаимодействие галогеналканов с водным раствором щёлочи
При обработке галогеналканов водными растворами щелочей галоген замещается на группу OH, образуется спирт. В нашем примере пропанол-2 из 2-бромпропана:
.
Применение спиртов
Среди спиртов человеком больше всего применяются метанол и этанол.
Метанол служит сырьём для получения формальдегида, некоторых пластмасс. Он чрезвычайно ядовит. Небольшое попадание метанола в организм приводит к потери зрения, а 30 мл к летальному исходу.
Этанол человек издревле получал в результате сбраживания фруктовых соков. Сейчас его применяют не только как алкогольный напиток, но и как растворитель лаков и красок, в медицинских целях, как сырьё для синтеза сложных эфиров, уксусной кислоты и в других сферах (рис. 2).
Между тем надо помнить, что даже незначительные дозы этанола в крови со временем могут привести к привыканию, а в дальнейшем и к сердечно-сосудистым заболеваниям, циррозу печени, психическим расстройствам.
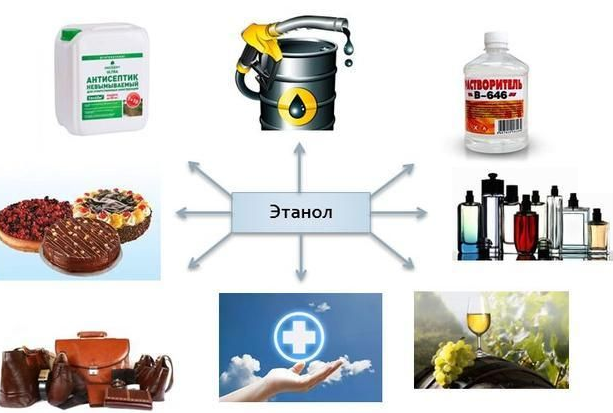 Рисунок 2. Применение этанола
Рисунок 2. Применение этанола
Упражнение 2
Закончите уравнения возможных химических реакций.
Упражнение 3
Составьте уравнения реакций по схеме.
Этан → хлорэтан → этанол → этилен
Формулы веществ записывайте структурно.
Контрольные вопросы
1. В чём особенности строения спиртов? Что означает «одноатомные спирты»?
2. Какие виды изомерии характерны для предельных одноатомных спиртов?
3. Какие химические свойства характерны для спиртов? Почему?
4. Назовите способы получения спиртов.
5. Укажите области применения этанола.
6. Расскажите о отрицательном воздействии на организм человека метанола и этанола.
Ответы
Упражнение 1
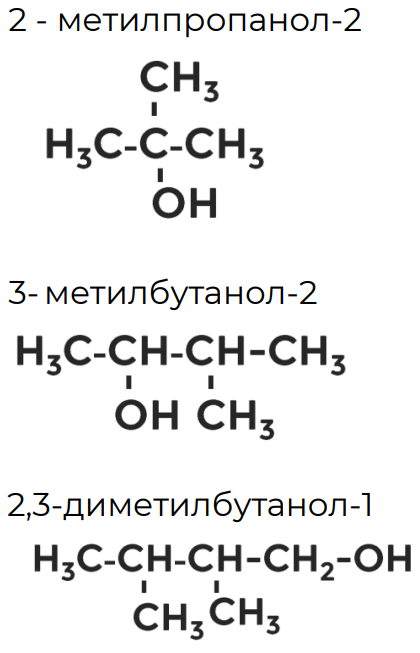
Упражнение 2
Упражнение 3
Этан → хлорэтан → этанол → этилен

