- Строение алкадиенов. Классификация и номенклатура. Сопряжённые алкадиены
- Изомерия алкадиенов
- Физические свойства алкадиенов
- Химические свойства алкадиенов
- Полимеризация алкадиенов. Каучуки
- Получение алкадиенов
- Применение алкадиенов
- рассмотреть особенности строения сопряжённых алкадиенов
- научиться составлять структурные формулы непредельных углеводородов — алкадиенов
- научиться составлять изомеры алкадиенов и давать им названия
- научиться составлять уравнения химических реакций с участием алкадиенов
- рассмотреть особенности полимеризации сопряжённых алкадиенов
- рассмотреть основные способы получения алкадиенов
- рассмотреть основные направления применения алкадиенов и каучуков
- Какие виды изомерии характерны для алкенов?
- Как связаны строение и химические свойства алкенов?
- Какие химические реакции характерны для непредельных углеводородов — алкенов? Почему?
- Укажите способы получения алкенов.
- Расскажите о применении алкенов.
Строение алкадиенов. Номенклатура
Алкадиены являются непредельными углеводородами. В отличие от алкенов они содержат 2 двойные связи. Поэтому и в названии алкадиенов мы встречаем суффиксы ди (два) и ен (двойная связь). Соответственно общая формула алкадиенов на 2 водорода меньше по сравнению с алкенами: .
Алкадиены классифицируют на 3 группы.
1. Изолированные
Двойные связи разделены минимум 2 одинарными связями. Например, пентадиен-1,4.

2. Кумулированные
Двойные связи у одного атома углерода.
Самый простой пример данных алкадиенов — это пропадиен.

3. Сопряжённые
Наибольшее значение в промышленности и технике имеют сопряжённые алкадиены, в молекулах которых две двойные углерод-углеродные связи разделены одной одинарной связью. Так возникает общая сопряжённая система между 4 атомами углерода (рис. 1).
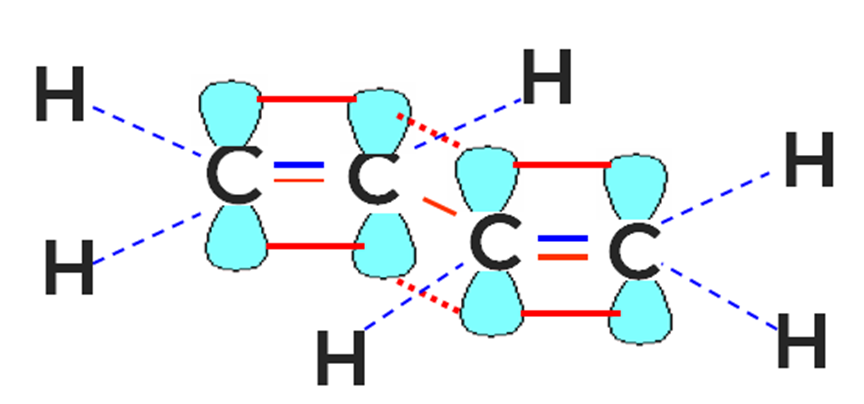 Рисунок 1. Строение бутадиена-1,3
Рисунок 1. Строение бутадиена-1,3
Это и обусловливает специфические свойства алкадиенов.
Пример 1
Дайте название следующему алкадиену.
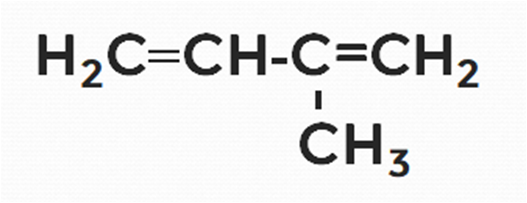
Решение
1. Нумерацию цепи делаем справа, где ближе разветвление от основной цепи.
2. Называем радикалы, цифрами указываем их расположение.
Получается следующее название 2-метил...
3. Даём название основной цепи, содержащей 4 атома углерода (бутадиен):
2-метилбутадиен.
4. Цифрами указываем расположение двойных связей: 2-метилбутадиен-1,3.
5. В итоге получаем следующее название: 2-метилбутадиен-1,3.
Упражнение 1
Составьте сокращённые структурные формулы следующих алкадиенов: бутадиен-1,3, 2-метилпентадиен-1,4, бутадиен-1,2.
Изомерия алкадиенов
Для алкадиенов, как и для алкенов, будут характерны следующие виды изомерии: углеродного скелета, положения кратных связей .
Такую же общую формулу, как у алкадиенов, имеют непредельные углеводороды алкины , содержащие тройную связь в составе. Следовательно, алкадиены являются изомерами алкинов.
Это межклассовая изомерия .
В результате реакции полимеризации сопряжённые алкадиены могут образовывать пространственные изомеры .
Физические свойства алкадиенов
Алкадиены различны по свойствам. Мы остановимся на самых значимых представителях этого класса углеводородов.
Бутадиен-1,3, или дивинил — легко сжижающийся газ с неприятным запахом, не растворяется в воде.
2-Метилбутадиен-1,3 (изопрен) — летучая жидкость, растворяется в большинстве углеводородных растворителях, не растворим в воде.
Химические свойства алкадиенов
Алкадиены — ненасыщенные углеводороды , поэтому для них, как и для алкенов, будут характерны реакции присоединения .
Мы рассмотрим реакции на основе сопряжённых алкадиенов, имеющих большое значение в промышленности.
У сопряжённых алкадиенов две двойные связи разделены одинарной, поэтому возможны три варианта протекания реакций присоединения.
1. 1,2 присоединение. Атомы присоединяются к первому и второму атомам углерода.
2. Полное (исчерпывающее) присоединение. Атомы присоединяются к четырём атомам углерода, соединённых двойными связями.
3. 1, 4 присоединение. Атомы присоединяются к первому и четвёртому атомам углерода, а между вторым и третьим атомами появляется двойная связь.
Рассмотрим эти варианты на примерах.
Реакции присоединения
1. Гидрирование
Гидрирование , как у вы уже знаете, это реакция присоединения водорода.
Рассмотрим варианты присоединения на примере сопряжённого алкадиена бутадиена-1,3.
1 вариант. 1,2 присоединение
Атомы водорода присоединяются к первому и второму атомам углерода. Одна двойная связь остаётся, образуется алкен бутен-1.
Реакция каталитическая и протекает при высокой температуре.
2 вариант. 1,2,3,4 присоединение
В данном случае образуется алкан — бутан:
.
3 вариант. 1,4 присоединение
3
В нашем примере из бутадиена-1,3 получился алкен бутен-2.
Следующие реакции протекают аналогично реакциям гидрирования. Мы будем рассматривать 1,2 и 1,4 присоединение.
2. Галогенирование
1,2 присоединение
1,4 присоединение
Алкадиены, как и алкены, обесцвечивают бромную воду . Это качественная реакция на вещества с кратными связями.
3. Гидрогалогенирование
Реакции протекают аналогично предыдущим.
1,2 присоединение протекает по правилу Марковникова, поэтому водород присоединяется к первому атому углерода, а галоген (хлор) ко второму:
.
1,4 присоединение
4. Реакция полимеризации
В результате реакции полимеризации сопряжённых алкадиенов образуются полимеры , которые называют каучуками .
Рассмотрим механизм реакции на примере полимеризации бутадиена-1,3. Двойная связь возникает между 2 и 3 атомами углерода. У крайних же атомов связи разрываются, благодаря чему образуются длинноцепочечные молекулы — каучуки (рис. 2).
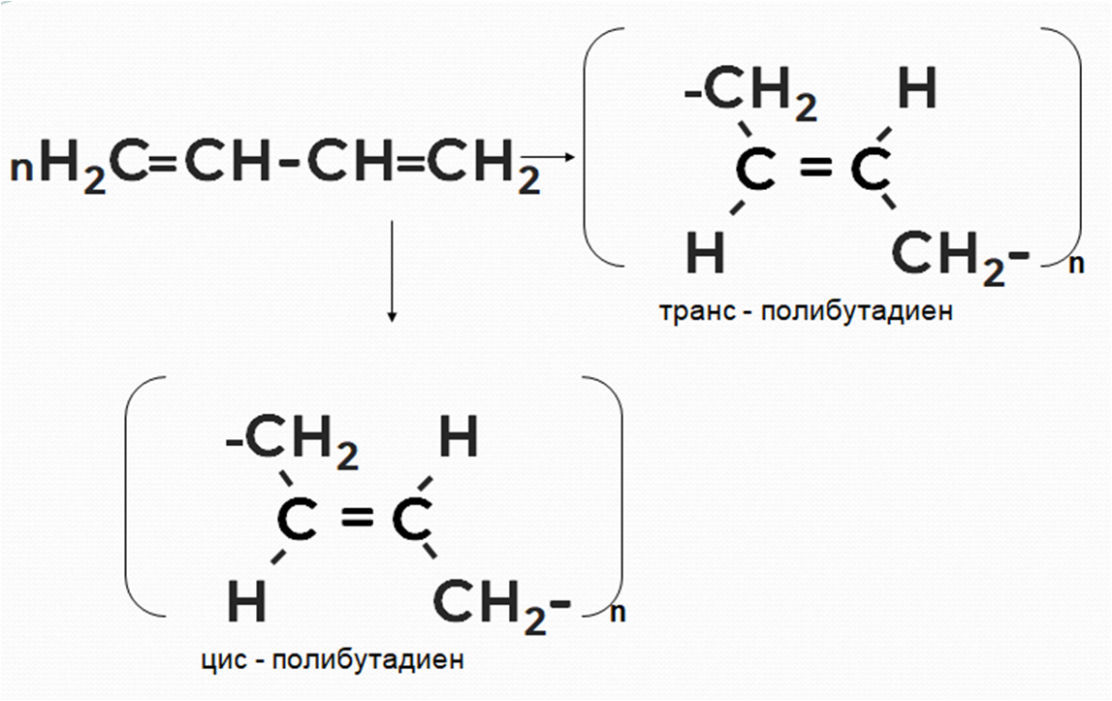 Рисунок 2. Схема пространственной полимеризации бутадиена-1,3
Рисунок 2. Схема пространственной полимеризации бутадиена-1,3
Бутадиеновый каучук — это первый синтетический каучук . В природе каучуки содержатся в соке некоторых растений, называемых каучуконосами, например гевеи (рис. 3). В XIX веке природный каучук, являющийся полимером 2-метилбутадиена-1,3, добывали только из растений. Не удивительна поэтому высокая стоимость резины , которую изготавливали из природного каучука.
Сейчас известно много различных каучуков. Все они синтезируются искусственно.
 Рисунок 3. Добыча каучука из гевеи бразильской
Рисунок 3. Добыча каучука из гевеи бразильской
Окислительно-восстановительные реакции
Все алкадиены горят с образованием углекислого газа и воды:
.
Получение алкадиенов
1. Дегидрирование алканов
В результате из бутана, содержащегося в природном газе, получают бутадиен-1,3
 Рисунок 4.
Рисунок 4. С. В. Лебедев
2. Синтез Лебедева
Лебедев Сергей Васильевич в 1927 году первым разработал промышленный способ получения синтетического каучука из этилового спирта.
Упражнение 2
Допишите левые части уравнений реакций с участием алкадиенов, укажите условия их протекания.
а)
б)
в)
г)
Применение алкадиенов
Сопряжённые алкадиены применяются для получения каучуков. Каучуки обладают эластичностью (эластомеры) , не пропускают воду и газы. Поэтому из каучуков изготавливают шины, строительные материалы, обувь. Более подробно области применения представлены на рисунке 5.
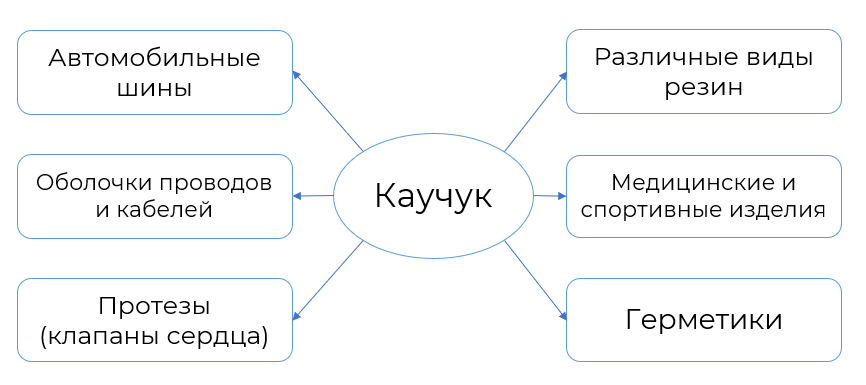 Рисунок 5. Применение каучуков
Рисунок 5. Применение каучуков
Однако натуральный каучук очень чувствителен к перепадам температур, поэтому приходится проводить процесс вулканизации с помощью серы, которая соединяет полимерные цепи каучука. Так появляется известный нам продукт — резина .
В отличие от каучуков она выдерживает как низкие, так и высокие температуры, лучше устойчива к механическому воздействию.
Упражнение 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
этанол → бутадиен-1,3 → 1,4-дибромбутен-2.
Формулы веществ записывайте структурно.
Контрольные вопросы
- В чём особенности строения сопряжённых алкадиенов?
- Какие виды изомерии характерны для алкадиенов?
- Почему реакции присоединения у сопряжённых алкадиенов протекают в разных положениях?
- Назовите способы получения алкадиенов.
- Что такое каучуки? Где они применяются?
Упражнение 1
бутадиен-1,3,
2-метилпентадиен-1,4,
бутадиен-1,2
Упражнение 2
а)
б)
в)
г)
Упражнение 4
этанол → бутадиен-1,3 → 1,4-дибромбутен-2

