- Строение алкенов. Номенклатура
- Изомерия алкенов
- Физические свойства алкенов
- Химические свойства алкенов
- Получение алкенов
- Применение алкенов
- научиться составлять структурные формулы непредельных углеводородов алкенов
- уметь составлять изомеры алкенов и давать им названия
- уметь составлять структурные формулы алкенов по названиям веществ
- уметь составлять уравнения химических реакций с участием алкенов
- знать основные способы получения алкенов
- знать основные направления применения алкенов
- Почему у алканов могут быть только изомеры углеродного скелета? Как связаны строение и химические свойства алканов?
- Какие химические реакции характерны для предельных углеводородов алканов? Почему?
- Укажите способы получения алканов в лаборатории и промышленности. Приведите примеры уравнений химических реакций.
- Расскажите о применении метана.
Алкены являются непредельными углеводородами. Это значит, что все связи углерода насыщены атомами водорода не максимально. Подобное возможно, если между углеродами присутствуют кратные связи (двойные и тройные). У алкенов это одна двойная связь.
Номенклатура алкенов сходна с алканами, только в названии присутствует суффикс -ен или -илен. Также цифрами указывается расположение двойной связи в алкене.
Общая формула алкенов . На два водорода меньше по сравнению с алканами. Как вы понимаете, это обусловлено наличием двойной связи. Если алкены имеют разветвлённое строение, то название им даётся по алгоритму, который мы рассматривали в теме «Алканы». Только атомы углерода нумеруем с конца, к которому ближе двойная связь.
Пример 1
Дайте название следующему алкену.
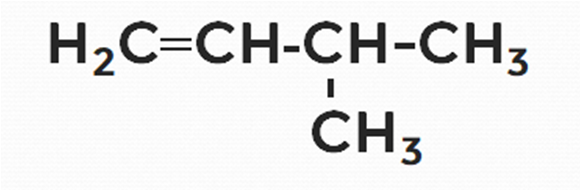
Решение
1. Нумерацию цепи делаем слева, где ближе двойная связь.
2. Называем радикалы, цифрами указываем их расположение.
Получается следующее название: 3-метил...
3. Даём название основной цепи, содержащей 4 атома углерода (бутен): 3-метилбутен.
4. Цифрой указываем расположение двойной связи: 3-метилбутен-1.
5. В итоге получаем следующее название: 3-метилбутен-1.
Упражнение 1
Составьте сокращённые структурные формулы метилпропилена, 2,3-диметилбутена-2, 2-метилбутена-1.
Изомерия алкенов
В молекулах алкенов присутствуют кратные, в данном случае двойные связи, поэтому для них будет характерна как изомерия углеродного скелета, так и положения кратных связей.
Кроме этого такую же общую формулу, как у алкенов, имеют циклические предельные углеводороды — циклоалканы. Следовательно, алкены являются изомерами циклоалканов. Это межклассовая изомерия.
Ещё у алкенов, содержащих двойную связь не крайнего атома углерода, встречается особый вид изомерии — геометрическая. Её ещё часто называют пространственной изомерией (рис. 1).
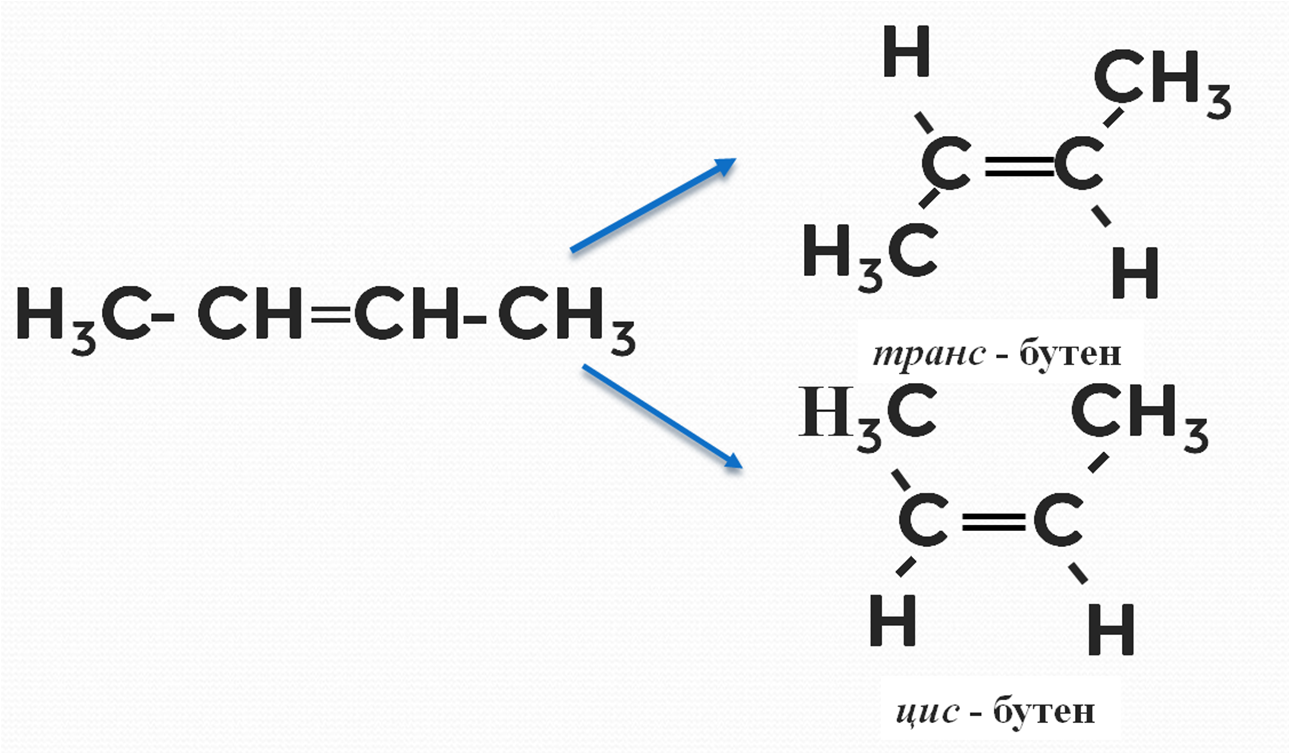 Рисунок 1. Пространственные изомеры бутена-2
Рисунок 1. Пространственные изомеры бутена-2
Упражнение 2
Составьте все возможные сокращённые структурные формулы алкенов состава , дайте им названия.
Физические свойства алкенов
Первые три члена гомологического ряда алкенов являются газообразными веществами; с пентена до 16 алкена жидкости. Далее следуют твёрдые вещества.
Химические свойства алкенов
Алкены — ненасыщенные углеводороды, поэтому для них будут характерны реакции присоединения.
Присоединение водорода мы будем называть гидрированием. Галогена —галогенированием, галогеноводорода — гидрогалогенированием, воды — гидратацией.
Алкены в отличие от алканов вступают в различные окислительно-восстановительные реакции помимо реакции горения (это тоже окислительно-восстановительная реакция!).
Реакции присоединения
1. Гидрирование
С реакцией гидрирования мы с вами встречались, когда рассматривали получение алканов. Только там была реакция, обратная гидрированию, а именно дегидрирование (отщепление водорода).
В реакции же гидрирования молекула водорода присоединяется к атомам углерода, соединённых двойной связью. В результате чего образуются алканы. В данном случае из пропена (пропилена) мы получили пропан:
.
Реакция каталитическая и протекает при высокой температуре.
2. Галогенирование
 Рисунок 2. Обесцвечивание алкенами бромной воды
Рисунок 2. Обесцвечивание алкенами бромной воды
Молекула галогена присоединяется к атомам углерода по двойной связи.
В данной реакции этилен присоединил молекулу хора и образовался 1,2-дихлорэтан.
Все алкены обесцвечивают бромную воду. Это качественная реакция не только на алкены, но и на другие вещества с кратными связями (рис. 2).
3. Гидрогалогенирование
В данной реакции участвуют молекулы галогеноводорода. Принцип тот же, что у реакций гидрирования и галогенирования, но в здесь водород в большинстве случаев присоединяется к наиболее гидрогенизированному атому углерода по двойной связи (рис. 3).
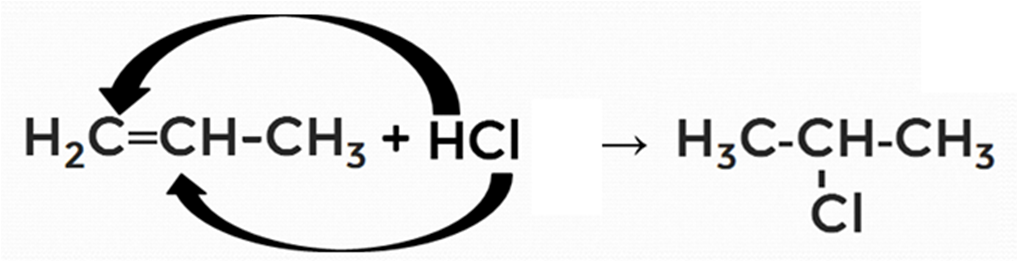 Рисунок 3. Схема реакции гидрохлорирования пропена
Рисунок 3. Схема реакции гидрохлорирования пропена
 Рисунок 4. В. В. Марковников
Рисунок 4. В. В. Марковников
В данной реакции пропен (пропилен) присоединяет молекулу хлороводорода, получается 2-хлорпропан.
Правило вывел отечественный учёный Владимир Васильевич Марковников (рис. 4).
Правило Марковникова: при присоединении галогеноводородов или воды к несимметричным алкенам атом водорода присоединяется к наиболее гидрогенизированному атому углерода (т. е. к атому углерода, связанному с большим числом атомов водорода), а атом галогена (или группа –ОН) — к наименее гидрогенизированному.
4. Гидратация
Гидратация — это присоединение воды.
Формулу воды для удобства можно представить как HOH. В результате реакции водород будет присоединяться к наиболее гидрогенизированному атому углерода по двойной связи (правило Марковникова), а гидроксильная группа OH к соседнему наименее гидрогенизированному атому (рис. 5).
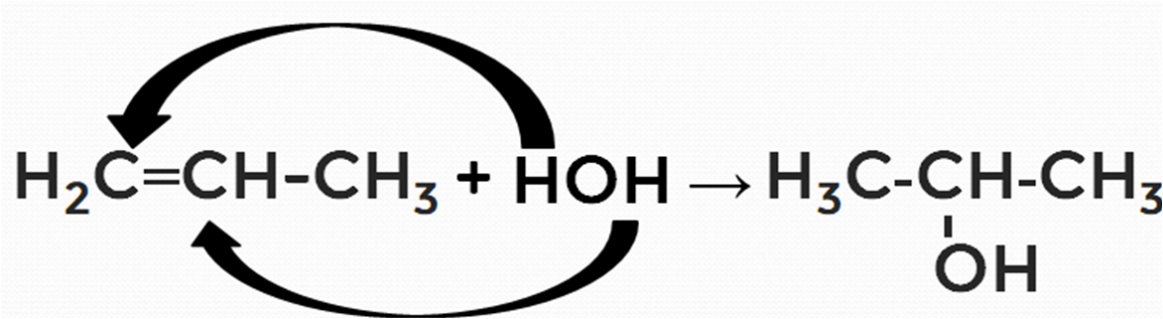 Рисунок 5. Схема реакции гидрохлорирования пропена
Рисунок 5. Схема реакции гидрохлорирования пропена
Из пропилена в результате гидратации образовался спирт пропанол-2.
В данной реакции этилен присоединяет молекулу воды и образуется спирт этанол ():
.
5. Реакции полимеризации
Полимеризация — это особый тип реакций присоединения, в результате которой молекулы мономера (алкены) соединяются между собой.
Таким образом, из мономеров получаются полимеры. В данном случае n показывает степень полимеризации.
Это могут быть структуры, состоящие из сотен и даже тысяч звеньев. Полученные полимеры находят огромное применение в технике, промышленности, в быту человека. Например, полиэтилен. Уравнение, получение которого мы привели ниже:
.
Полиэтилен применяется в товарах бытового применения, строительстве, медицине, в обмотке проводов для линии электропередач.
Окислительно-восстановительные реакции
Все алкены участвуют в окислительно-восстановительных реакциях. Наиболее полное окисление — это реакции горения.
1. Горение алкенов
 Рисунок 6. Обесцвечивание алкенами раствора перманганат калия в кислой среде
Рисунок 6. Обесцвечивание алкенами раствора перманганат калия в кислой среде
Алкены, как и многие органические вещества, сгорают с образованием углекислого газа и воды:
.
Помимо реакции горения алкены окисляются различными окислителями. Например, обесцвечивают раствор перманганата калия () (рис. 6).
Получение алкенов
Многие реакции, связанные с получением алкенов, мы уже встречали в теме «Алканы» или в химических свойствах самих алкенов.
1. Крекинг алканов
Вы наверняка уже знаете, что в промышленности разложением алканов под действием высокой температуры или катализаторов получают как алканы, так и алкены с меньшей углеродной цепочкой.
2. Дегидрирование алканов
Реакция, обратная гидрированию алкенов:
3. Дегидратация спиртов
Данное превращение является обратной реакцией гидратации самих алкенов. Также отщепление воды происходит по правилу, противоположному правилу Марковникова (правило Зайцева). Водород отщепляется от соседнего углерода, соединённого с группой OH или галогеном (рис. 7).
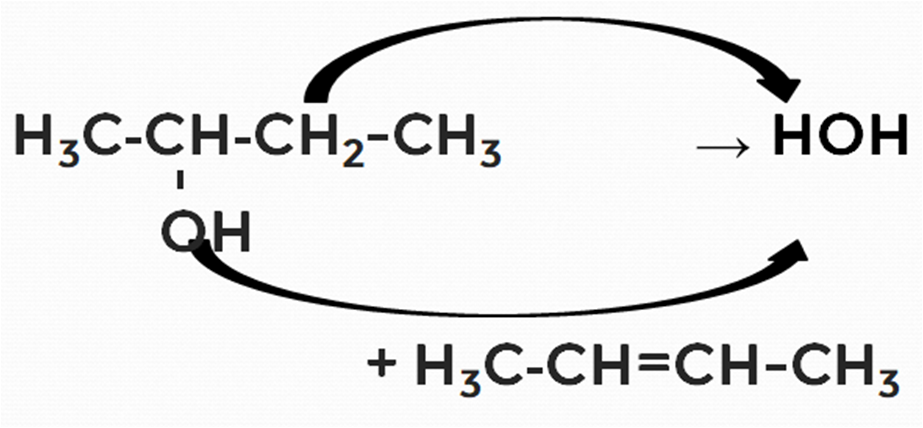 Рисунок 7. Схема реакции дегидратации бутанола-2 в бутен-2
Рисунок 7. Схема реакции дегидратации бутанола-2 в бутен-2
 Рисунок 8. А. М. Зайцев
Рисунок 8. А. М. Зайцев
Правило Зайцева: отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
1. Дегалогенирование галогеналканов спиртовым раствором щелочи
В результате взаимодействия галогеналкана со спиртовым раствором щелочи получается алкен.
Таким образом из 2-бромбутана получили бутен-2.
2. Дегалогенирование дигалогеналканов
В данных реакциях двухвалентные металлы (чаще всего цинк или магний) отсоединяют два соседних галогена от дигалогеналкана. Образуется алкен. В нашем случае этен из 1,2-дихлорэтена:
.
Упражнение 3
Допишите левые части уравнений реакций, укажите условия их протекания:
а)
б)
в)
г)
д)
Применение алкенов
Алкены находят широкое применение. В первую очередь это получение полимеров. Полиэтилен, полипропилен и другие полимеры на основе алкенов встречаются повсеместно в быту, в промышленности. Сейчас трудно представить современные приборы, в которых не было бы полимеров. Кроме этого, этилен используется в сельском хозяйстве для ускорения созревания плодов.
 Рисунок 9. Применение алкенов
Рисунок 9. Применение алкенов
Упражнение 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
.
Формулы веществ записывайте структурно.
Контрольные вопросы
1. В чём особенности строения алкенов? Почему их относят к непредельным углеводородам?
2. Какие виды изомерии характерны для алкенов?
3. Какие химические свойства типичны для алкенов? Объясните почему.
4. Назовите способы получения алкенов.
5. Как вы понимаете правила Марковникова и Зайцева?
Упражнение 1
метилпропен , 2,3-диметилбутен-2
,
2-метилбутен-1
Упражнение 2
— бутен-1
— бутен-2
— метилпропен
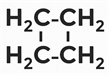 — циклобутан
— циклобутан
Упражнение 3
а)
б)
в)
г)
д) .
Упражнение 4
1.
2.
3.

