- Классификация химических соединений по элементному составу
- Классификация химических соединений по агрегатному состоянию
- Классификация химических соединений по растворимости в воде
- знать критерии классификации химических соединений
- уметь применять приёмы классификации для определения типа химических соединений
- Из чего состоят физические тела?
- Что такое вещество и чем образованы вещества?
- Сколько видов атомов известно на данный момент?
Нас окружает огромное количество различных веществ. Например, в самой обширной базе данных по химическим веществам содержатся сведения о 125 миллионах веществ. Чтобы ориентироваться в таком разнообразии веществ, необходимо их классифицировать.
Все вещества можно разделить на две большие группы.
Простые вещества — вещества, состоящие из атомов одного химического элемента (азот , кислород , озон , белый фосфор ).
Сложные вещества — вещества, состоящие из атомов различных химических элементов (вода , углекислый газ , поваренная соль ).
Конечно, мир сложных веществ намного более разнообразен, в связи с этим возникла необходимость классификации таких соединений. Для этого используют различные критерии. Мы рассмотрим три из них: элементный состав веществ, агрегатное состояние и растворимость в воде.
Классификация химических соединений по элементному составу
- Бинарные соединения
Binarius (лат.) означает «двойной, состоящий из двух частей», то есть бинарные соединения — соединения, состоящие из атомов двух химических элементов.
Бинарные соединения могут состоять из атомов-металла и атомов-неметалла. Например, — гидрид калия, — гидрид кальция. Металлы в таких соединениях менее электроотрицательны и поэтому будут проявлять положительную степень окисления, а неметаллы — отрицательную.
Названия этих веществ будут состоять из двух слов. Первое слово — основа русского или латинского названия неметалла с окончанием –ид. Второе слово — название металла. Например, — хлорид натрия, — нитрид лития,
— карбид кальция.
В состав бинарного соединения также могут входить два разных неметалла. Например, — хлорид фосфора (III), — фторид кислорода. В формуле, как правило, на первое место нужно поставить неметалл, у которого электроотрицательность меньше: он будет приобретать положительную степень окисления, а второй неметалл — отрицательную.
Название строится уже по знакомому нам принципу. Первое слово — основа русского или латинского названия неметалла, который стоит в формуле на втором месте, а второе слово — название неметалла, который стоит на первом месте. Например, — хлорид серы (II), — сульфид углерода (IV).
Летучие водородные соединения — особая группа бинарных соединений, состоящих из атомов водорода и другого неметалла, например, — хлороводород, — сероводород.
Самой известной группой бинарных соединений являются оксиды.
Оксиды можно разделить на две группы.
Несолеобразующие оксиды — оксиды, которые не взаимодействуют с кислотами и щелочами и не образуют солей. Несолеобразующих оксидов немного, например, , , , .
Солеобразующие оксиды — оксиды, которые взаимодействуют с кислотами и щелочами с образованием соли и воды. Солеобразующие оксиды подразделяются на три группы в зависимости от характера (кислотные, основные, амфотерные).
Основные оксиды образованы металлами в степенях окисления +1 и +2. Исключения: оксиды цинка, бериллия, свинца II и олова II.
Амфотерные оксиды образованы металлами в степенях окисления +3 и +4. В том числе и оксиды цинка, бериллия, свинца II и олова II.
Кислотные оксиды образованы неметаллами, а также металлами в степенях окисления +5, +6 и +7.
- Многоэлементные соединения
Рассмотрим две группы соединений — гидроксиды и соли. Начнём с гидроксидов.
Гидроксиды — это продукты прямого или косвенного соединения оксидов с водой.
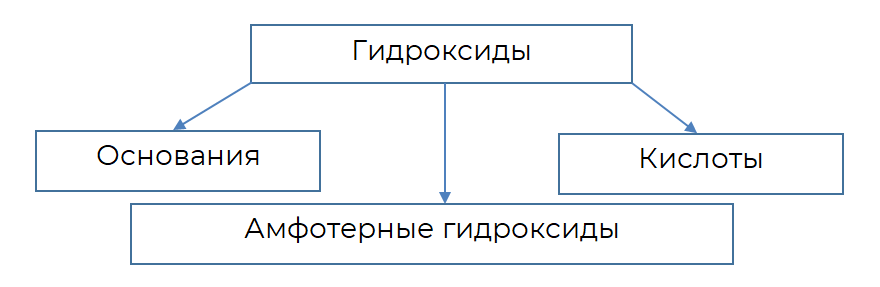
Вся группа гидроксидов представлена тремя большими классами — это основания, амфотерные гидроксиды и кислоты.
Основания — гидроксиды металлов IA группы (щелочные металлы) и IIA группы (кроме бериллия, он амфотерный). Например, — гидроксид калия,
— гидроксид бария. Также гидроксиды некоторых металлов в низших степенях окисления имеют основный характер: — гидроксид железа (II), — гидроксид меди (II).
Амфотерные гидроксиды, как правило, образуются металлами в степенях окисления +3, +4. Например, — гидроксид алюминия, — гидроксид железа (III).
Кислородсодержащие кислоты также являются гидроксидами. Такие гидроксиды образуются неметаллами и металлами с высокими степенями окисления (+5, +6, +7). Гидроксильная группа в химических формулах кислот скрыта, например, — серная кислота, — дихромовая кислота. Но если посмотреть на структурные формулы этих кислот, то можно увидеть наличие в них гидроксильных групп –, как во всех гидроксидах.
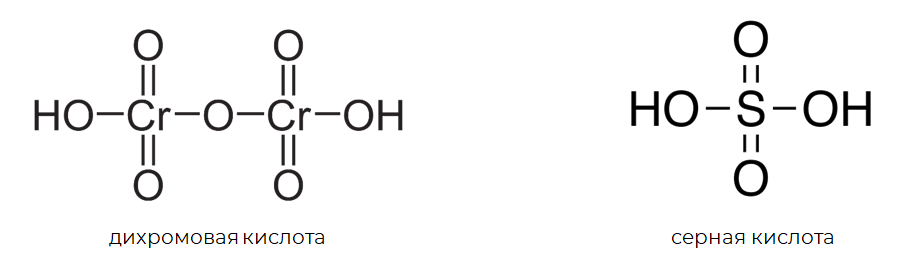
Теперь рассмотрим самый большой класс неорганических соединений — соли.
Соли — химические соединения, состоящие из ионов металла (или ионов аммония) и кислотного остатка.
Соли можно разделить на четыре группы:
- средние соли — соли, в которых замещены все атомы водорода. Например, — карбонат калия, — сульфид железа (II);
- кислые соли — соли, в которых атомами металла замещены не все атомы водорода. Например, — гидросульфид натрия, — гидросульфит калия, — дигидрофосфат бария;
- основные соли — соли, в которых кислотными остатками замещены не все гидроксильные группы у основания или амфотерного гидроксида. Например, — гидроксохлорид калия;
- комплексные соли — соли, в состав которых входят комплексные частицы. Например, , .
Пример 1
Определите, к каким классам относят вещества: , и .
Решение:
1. : содержит гидроксогруппы и металл в степени окисления +2. Следовательно, это основание. По таблице растворимости определяем, что оно нерастворимо, а значит, слабое.
2. : состоит из водорода и карбоната. Следовательно, это кислота. В число сильных не входит, значит, слабая.
3. : состоит из металла и кислотного остатка — соль. Также содержит водород — соль кислая.
Ответ: слабое основание, слабая кислота, кислая соль.
Упражнение 1
1. Приведите по три примера для каждого из четырёх основных классов химических веществ.
2. К какому типу относится каждый из оксидов: , , , ?
Классификация химических соединений по агрегатному состоянию
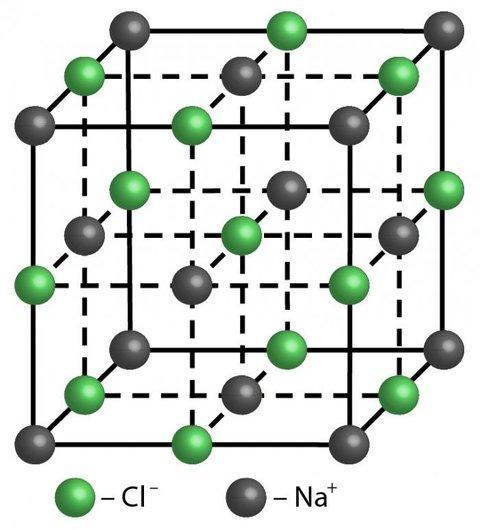 Рис. 1. Кристаллическая решётка хлорида натрия
Рис. 1. Кристаллическая решётка хлорида натрия
Мы знаем, что вещества могут находиться в трёх агрегатных состояниях: газообразном, жидком и твёрдом. Большинство твёрдых веществ — кристаллические. Их структура представлена кристаллической решёткой: в ней все частицы расположены очень упорядоченно и находятся строго на своих местах. На рисунке представлена кристаллическая решётка хлорида натрия.
Существуют вещества, которые имеют очень вязкую структуру, и их можно считать твёрдыми. Но частицы в них расположены неупорядоченно. Такие твёрдые вещества называют аморфными. Например, стекло, смола, жевательная резинка, пластилин, большинство пластмасс.
Различие кристаллических и аморфных веществ состоит в отношении к нагреванию. Если нагревать аморфное вещество, оно будет становиться более текучим и затем постепенно перейдёт в жидкое состояние. Кристаллические вещества имеют строго фиксированное значение температуры плавления. Поэтому, достигнув этого значения, твёрдое вещество перейдёт в жидкое агрегатное состояние.
Классификация химических соединений по растворимости
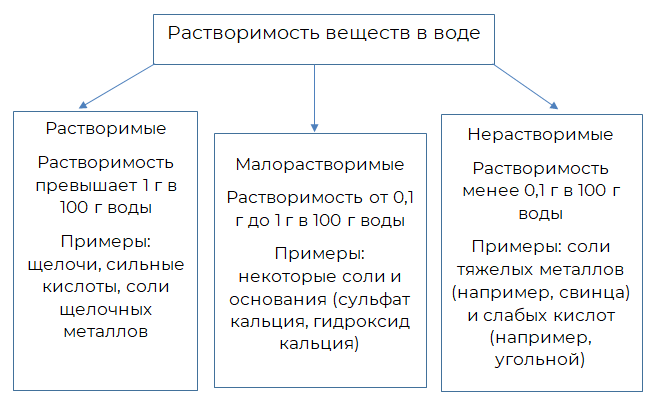
По отношению к воде химические соединения подразделяются на растворимые, малорастворимые и нерастворимые.
В таблице растворимости есть вещества, на месте которых стоит прочерк. Это значит, что вещество не просто не растворяется в воде, а оно тут же ею полностью разлагается.
Мы рассмотрели несколько критериев, по которым можно классифицировать химические вещества: элементный состав, агрегатное состояние и растворимость в воде. Классификация позволяет создать упорядоченную структуру и систему, которые позволяют чётко характеризовать вещества и легко ориентироваться в огромном количестве химических соединений.
Контрольные вопросы
- Какие группы соединений относятся к бинарным и почему?
- Что такое гидроксиды и на какие группы они делятся?
- Как отличить аморфные вещества от кристаллических?
- На какие группы делятся вещества по отношению к воде?
Упражнение 1
2. Кислотный, несолеобразующий, основный, амфотерный.

