- Строение аренов. Классификация и номенклатура
- Физические свойства аренов
- Химические свойства аренов
- Получение аренов
- Применение аренов
- знать особенности строения бензола и его гомологов
- уметь составлять структурные формулы бензола и его гомологов
- уметь составлять уравнения химических реакций замещения с участием бензола
- знать основные направления применения бензола и его гомологов
- Чем отличаются сопряжённые алкадиены от других диенов?
- Какие вещества относят к непредельным углеводородам?
- Укажите способы получения алкинов. Приведите примеры уравнений химических реакций.
- Расскажите о применении алкинов.
Строение бензола. Гомологи бензола
 Рисунок 1. Майкл Фарадей
Рисунок 1. Майкл Фарадей
Изучение строения бензола является увлекательной страницей в истории химии. Впервые бензол получил Иоганн Глаубер ещё в 1649 году из каменноугольной смолы. Однако состав вещества учёный не смог описать. В 1825 году английский физик Майкл Фарадей выделил бензол из конденсата светильного газа и установил его молекулярную
формулу — . Это было второе рождение бензола.
Чуть позже в 1833 году немецкий учёный Эйльгард Мичерлих синтезирует бензол из соли бензойной кислоты. Отсюда и пошло название вещества — бензол.
Однако никто из исследователей не смог установить строение вещества. Предлагались различные версии.
 Рисунок 2. Фридрих Август Кекуле
Рисунок 2. Фридрих Август Кекуле
Учитывая малое количество атомов водорода по отношению к атомам углерода, бензол должен содержать кратные связи, но он не обесцвечивал бромную воду и раствор перманганата калия. А это качественные реакции на двойные и тройные связи.
Противоречие удалось решить автору теории валентности Фридриху Августу Кекуле в 1865 году.
Учёный предложил замкнуть 6 атомов углерода в шестигранник. Получилась следующая структурная формула бензола.
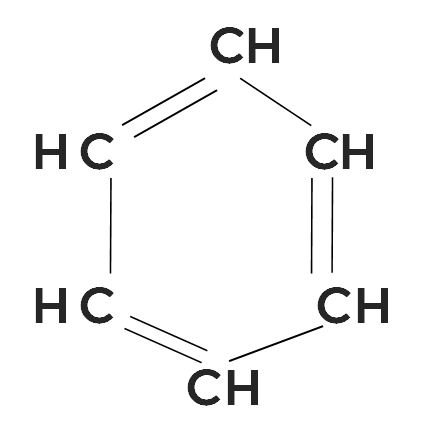
Структурную формулу учёный вывел во сне. Вот как говорит сам Кекуле о своём научном открытии: «Перед моими глазами прыгали атомы, они сливались в более крупные структуры, похожие на змей. Как заворожённый, я следил за их танцем, как вдруг одна из «змей» схватила себя за хвост и дразняще затанцевала перед моими глазами. Будто пронзенный молнией, я проснулся: структура бензола представляет из себя замкнутое кольцо!»
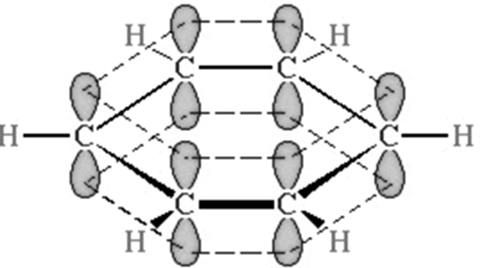 Рисунок 3. Схема делокализации
Рисунок 3. Схема делокализации π электронов
В итоге в строении молекулы бензола и всех его гомологов мы наблюдаем общее кольцо, названной в честь бензола бензольным.
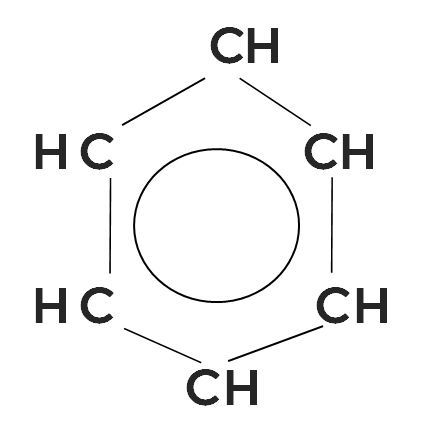
Кольцо напоминает арену цирка, поэтому данные углеводороды и получили название арены, иными словами, они все содержат бензольное кольцо.
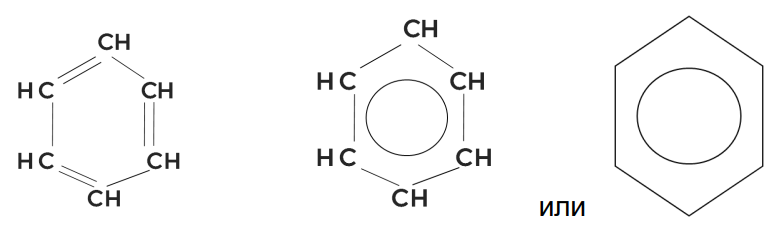
В заданиях можно использовать любую из этих формул, которые теперь стали называться формулой Кекуле.
Радикал на основе бензола будет называться не бензил (как было бы логически), а фенил: или структурно:
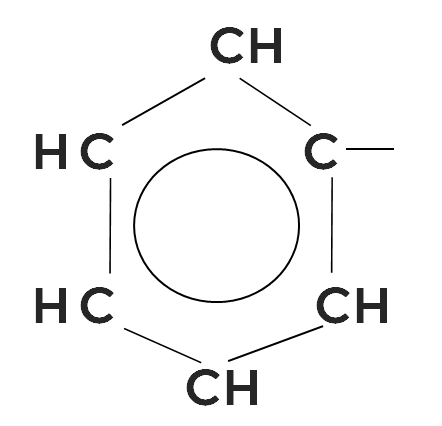
Гомологи бензола
Бензол является родоначальником гомологического ряда аренов. Достаточно заменить водород на углеводородный радикал, например, на метильный, как мы получим новый арен, гомолог бензола.
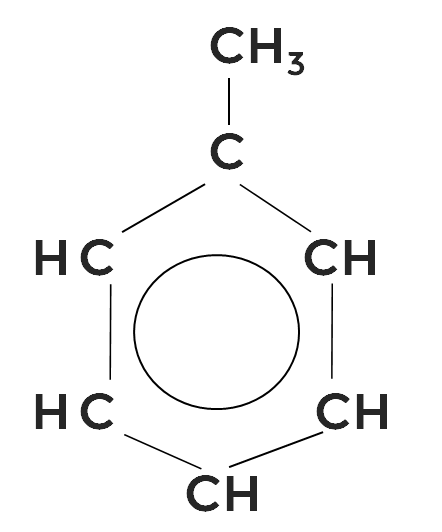
Даже название его будет связано с бензолом — метилбензол Исторически его чаще называют толуолом.
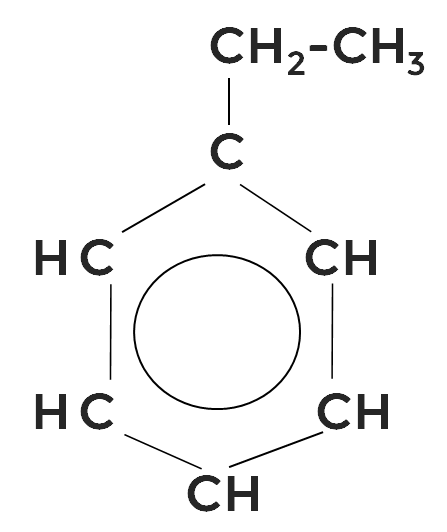
Если вместо метильного радикала использовать этильный, получим структурную формулу этилбензола:
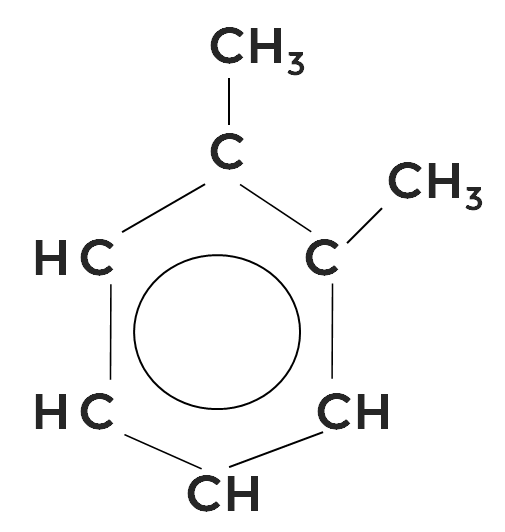
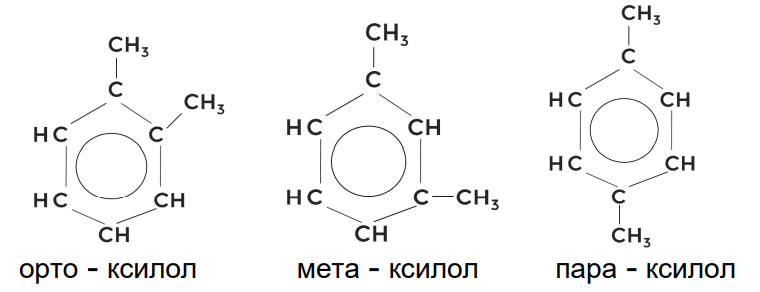
Заменив два водорода на метильные радикалы, получаем диметилбензол. В нашем примере это 1,2-диметилбензол или орто-ксилол:
Общая формула аренов , причём .
По расположению радикалов относительно бензольного кольца выделяют орто-положение, когда радикалы расположены рядом. Мета-положение — через один атом углерода. А также пара-положение, если радикалы располагаются напротив друг друга.
Упражнение 1
Составьте структурные формулы всех аренов состава Дайте им названия.
Пример 1
Найдите массовую долю углерода в толуоле
Решение
1. Найдем молярную массу формулы :
2. Рассчитаем массовую долю углерода по формуле:
.
Где Ar — относительная атомная масса углерода, М — молярная масса толуола .
3. , следовательно,
Физические свойства аренов
Бензол и его ближайшие гомологи — бесцветные жидкие вещества, нерастворимые в воде, но хорошо растворяющиеся во многих органических жидкостях. Легче воды. Огнеопасны.
Бензол токсичен (вызывает заболевание крови — лейкемию).
Кроме этого, арены обладают запахами, отсюда и пошло их второе название — ароматические!
Химические свойства аренов
Арены, являясь непредельными углеводородами, содержат в составе три двойные связи, объединённые в общее бензольное кольцо.
Оно в свою очередь достаточно прочное, по этой причине реакции присоединения для аренов не типичны. Они протекают с большим трудом при определённых условиях. Гораздо чаще арены вступают в реакции замещения. Протекают они легче чем у алканов. Сходство наблюдается в самих процессах. Это тоже галогенирование и нитрование.
Реакции замещения
1. Галогенирование
Бензол, как и его гомологи, вступает в реакции замещения с галогенами под действием температуры и в присутствии катализаторов (галогениды алюминия или железа).
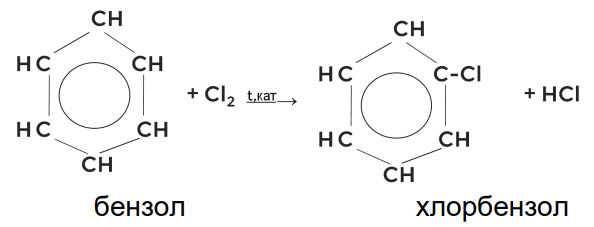
Причём замещение может происходить у любого атома углерода, так как они равноценны.
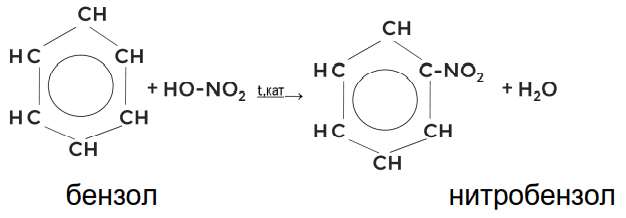
2. Нитрование
Арены вступают в реакцию нитрования в присутствии водоотнимающего
средства — концентрированной серной кислоты.
Реакции присоединения
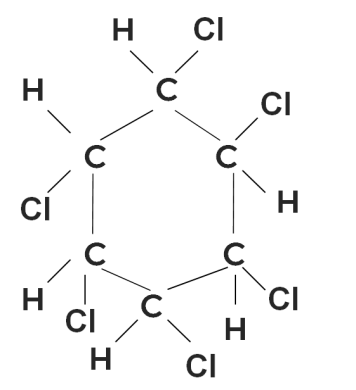
Реакции присоединения не характерны для аренов, так как в результате данного процесса необходимо разрывать всё бензольное кольцо, то есть присоединять шесть атомов, что достаточно трудоёмко.
Бензол вступает в реакцию присоединения с хлором только под действием света. В результате образуется гексахлорциклогексан, ранее используемый как пестицид в сельском хозяйстве.
Окислительно-восстановительные реакции
 Рисунок 4. Горение бензола
Рисунок 4. Горение бензола
Все арены горят. Бензол горит коптящим пламенем, как и ацетилен. Чем больше массовые доли углерода в молекуле, тем более коптящее будет пламя в результате горения.
Бензол не обесцвечивает раствор перманганата калия в отличие от своих гомологов.
Упражнение 2
Какое из веществ горит более коптящим пламенем: метан, этилен и бензол? Докажите расчётами. Определите массовые доли углерода у каждого из веществ.
Получение аренов
Бензол и его гомологи выделяют из нефти и нефтепродуктов, а также в результате коксования каменного угля.
Существуют и другие способы синтеза аренов.
1. Тримеризация алкинов
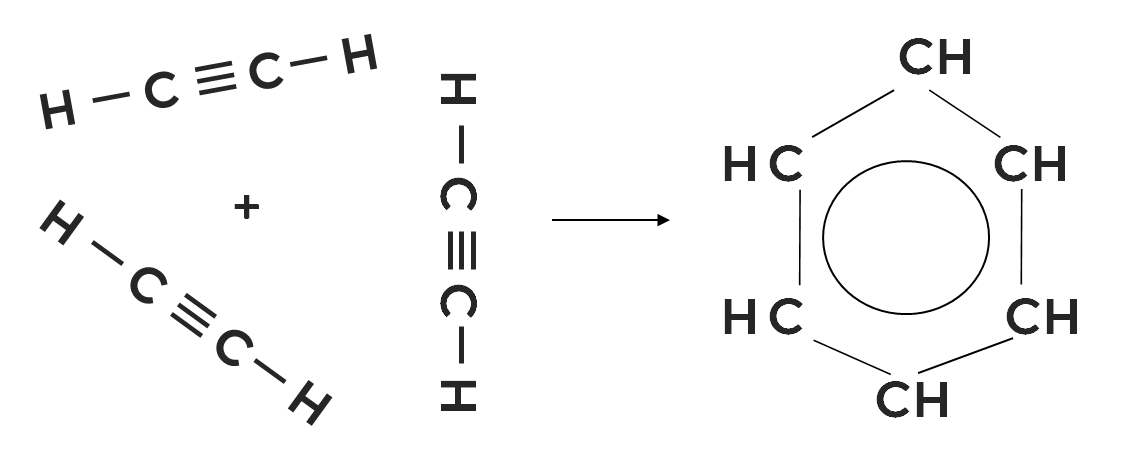
В результате из ацетилена получают бензол. Реакция идёт при высокой температуре и в присутствии катализатора (активированного угля).
2. Дегидроциклизация (дегидрирование и циклизация) алканов в присутствии катализатора:
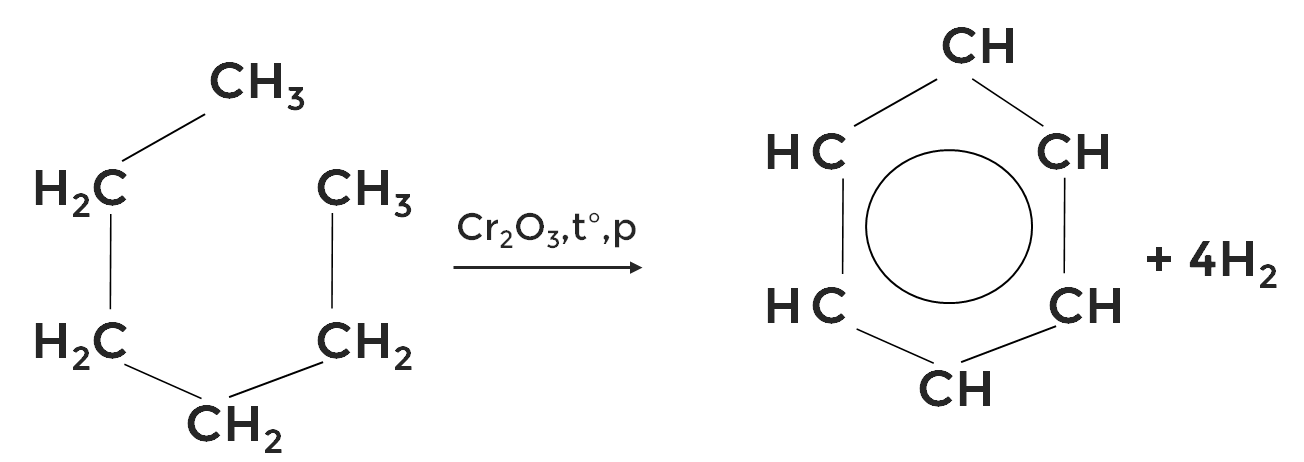
В нашем случае из гексана получается бензол.
Упражнение 3
Допишите левые части уравнений реакций с участием алкадиенов, укажите условия их протекания.
а)
б)
в)
Применение аренов
Бензол и его гомологи широко применяются человеком.
Арены не растворимы в воде, поэтому их нередко отделяют от слоя воды методом экстракции. Слой арена будет находится выше воды, наподобие растительного масла в воде.
Экстракция — это извлечение вещества из раствора или сухой смеси с помощью растворителя, практически не смешивающегося с исходной смесью. Экстракция может быть разовой или непрерывной.
Арены хорошо растворяются в органических растворителях, что находит применение в хозяйственной деятельности человека. Их применяют для растворения жиров, масляных красок, лаков, смол. В качестве примера можно привести органический растворитель «Сольвент».
Нитробензол и нитротолуол (тротил) применяют как взрывчатые вещества; нитротолуол применяется для синтеза анилиновых красителей; ксилолы входят в состав моторных масел; из изопропилбензола получают ацетон и фенол.
Ещё варианты применения аренов приведены на схеме (рис. 5).
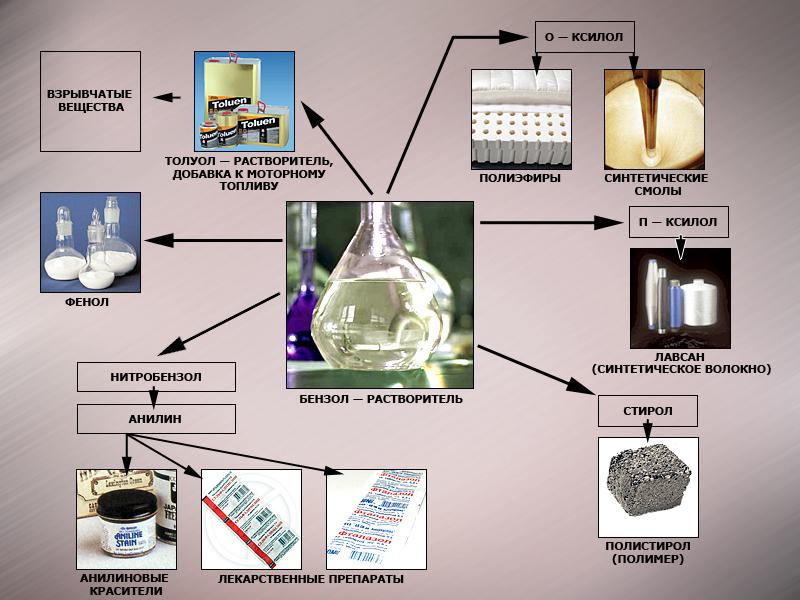 Рисунок 5. Варианты применения аренов
Рисунок 5. Варианты применения аренов
Упражнение 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Этан → ацетилен → бензол → хлорбензол.
Формулы веществ записывайте структурно.
Контрольные вопросы
- Расскажите о истории изучения строения бензола.
- Какие химические реакции характерны для аренов?
- Назовите способы получения аренов.
- Расскажите о применении бензола.
Ответы
Упражнение 1
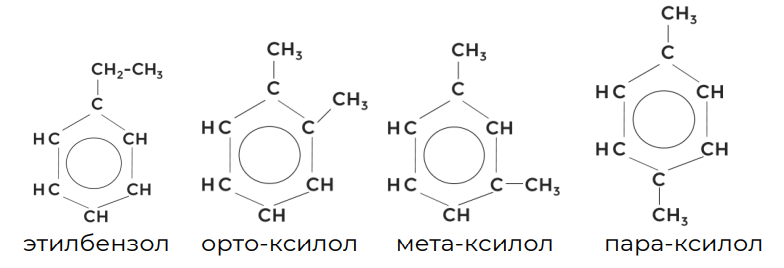
Упражнение 2
Вывод: бензол горит более коптящим пламенем.
Упражнение 3
а)
б)
в)
Упражнение 4

