- Общая характеристика VA-группы
- Характеристика азота
- Химические свойства азота
- Применение азота
- рассмотреть строение атома азота
- дать характеристику физическим и химическим свойствам азота
- раскрыть роль азота в природе
- Какие элементы составляют VA-группу Периодической системы химических элементов Д. И. Менделеева?
- Охарактеризуйте азот по положению в периодической системе.
В VA-группу периодической системы химических элементов входят шесть элементов: азот N, фосфор P, мышьяк As, сурьма Sb, висмут Bi и московий Mc.
По номеру группы можно судить о том, какое число электронов содержит внешний энергетический уровень. Пятая группа — пять электронов. Для завершения уровня и достижения устойчивого состояния данным элементам не хватает трёх электронов. Азот и фосфор — типичные неметаллы, висмут уже металл.
Опять же по номеру группы можно определить высшую степень окисления элементов данной группы. Она равна +5. А минимальная степень окисления зависит от того, сколько электронов может принять элемент для достижения устойчивого состояния. В 8 классе мы уже разбирали, что элементам пятой группы не хватает трёх электронов. Они принимают их и приобретают степень окисления −3. Эта степень окисления минимальная.
Общая формула высшего оксида — (R — элемент VA-группы). Формула летучего водородного соединения — RH3.
Азот
Азот — один из главных элементов жизни. Атомы азота входят в состав белков и нуклеиновых кислот — важнейших органических веществ живых организмов.
В природе азот находится в основном в газообразном состоянии в виде простого вещества с формулой N2. Также в литосфере азот встречается в виде некоторых минералов. Наиболее значимые из них — селитры.
Простое вещество — газ без цвета и запаха, малорастворим в воде. В атмосферном воздухе содержится 78 % азота по объёму (кислорода около 21 %).
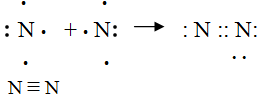 Рисунок 1. Строение молекулы азота
Рисунок 1. Строение молекулы азота
При нормальных условиях азот малоактивен. Он не взаимодействует с кислородом при небольших температурах, с концентрированными кислотами и щелочами, а также металлами.
Такой небольшой реакционной способности азота есть логическое объяснение. Молекулу азота трудно разрушить из-за её строения. Два атома азота связаны в молекуле ковалентной неполярной связью. При образовании этой связи задействуется целых три общие электронные пары
(рис. 1). То есть связь в молекуле азота тройная. Этим и обусловливается её высокая прочность.
Химические свойства азота
Окислительные свойства
1. Взаимодействие с металлами
Азот реагирует с металлами при нагревании с образованием нитридов, в которых он проявляет степень окисления −3:
.
Литий может взаимодействовать с влажным азотом при комнатной температуре без нагревания:
.
2. Взаимодействие с водородом
В результате образуется аммиак — один из важнейших продуктов химического производства:
.
Восстановительные свойства
1. Взаимодействие с кислородом
 Рисунок 2. Нитрифицирующие бактерии
Рисунок 2. Нитрифицирующие бактерии
Данная реакция происходит при температуре:
.
В круговороте азота в природе важнейшая роль отведена живым организмам. На корнях бобовых растений живут особые бактерии, которые связывают атмосферный азот и превращают его в минеральные соли. Эти соли способны усваивать растения.
 Рисунок 3. Жидкий азот
Рисунок 3. Жидкий азот
По большей части азот используется для синтеза аммиака. Аммиак же применяют для производства удобрений, азотной кислоты, красителей и лекарств, а также взрывчатых веществ.
В жидком азоте, который имеет температуру −196 °С, хранят клетки, органы, ткани и другие биологические объекты. Жидким азотом замораживают продукты и полуфабрикаты. А селитры — природные соединения азота — используют для производства азотных удобрений.
Азот — один из важнейших элементов на Земле. Азот как простое вещество обозначается формулой и относится к неметаллам. Химически азот малоактивен, что обусловлено тройной связью, которой связаны атомы в молекуле . Азот взаимодействует с металлами с образованием нитридов, с водородом с образованием аммиака и с кислородом с образованием оксида.
Контрольные вопросы
- Дайте общую характеристику VA-группы Периодической системы химических элементов Д. И. Менделеева.
- В чём особенность круговорота азота в природе?
- Вычислите объём аммиака, который можно получить при взаимодействии азота с 33,6 л водорода.

