- Строение атома фосфора
- Фосфор как простое вещество
- Химические свойства фосфора
- Соединения фосфора
- рассмотреть строение атома фосфора
- дать характеристику фосфору как простому веществу и его соединениям
- Охарактеризуйте положение фосфора в Периодической системе химических элементов Д. И. Менделеева.
- Сравните строение атома азота и фосфора. Какой элемент будет обладать более выраженными окислительными свойствами, а какой — восстановительными? Объясните.
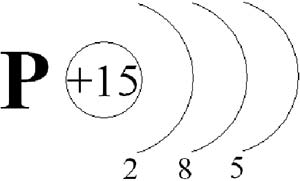 Рисунок 1. Строение атома фосфора
Рисунок 1. Строение атома фосфора
Порядковый номер фосфора 15, следовательно, атом фосфора будет содержать 15 протонов в ядре и 15 электронов в электронной оболочке, располагающиеся на трёх энергетических уровнях.
Для завершения внешнего электронного слоя и приобретения устойчивого состояния фосфору не хватает трёх электронов. Он принимает их и приобретает степень окисления −3. Конечно, электроны в атоме фосфора находятся дальше от ядра, чем у атома азота, и менее сильно связаны с ним, но фосфор всё же является типичным неметаллом. Также фосфор способен отдать все пять электронов с последнего энергетического уровня, тогда его степень окисления повысится до +5. Она максимальна для фосфора.
К металлам или неметаллам следует отнести фосфор? Почему?
Нахождение в природе
 Рисунок 2. Апатит
Рисунок 2. Апатит
В свободном состоянии фосфор не встречается. Он образует примерно 190 минералов. Важнейшие из
них — апатиты и фосфориты, по больше части состоящие из фосфата кальция.
Фосфор относится к биогенным элементам. Он входит в состав всех живых организмов. Например, в плодах, семенах, в жировой ткани, а также в головном мозге.
 Рисунок 3. Фосфорит
Рисунок 3. Фосфорит
Скелет человека и животных главным образом формируется за счёт соединений фосфора и кальция.
Главный источник энергии для каждой клетки — АТФ (аденозинтрифосфорная кислота) — соединение фосфора.
Фосфор как простое вещество
Для фосфора характерно явление аллотропии. Он образует несколько аллотропных модификаций, самые известные — белый и красный фосфор.
 Рисунок 4. Белый фосфор
Рисунок 4. Белый фосфор
- Белый фосфор
По структуре очень похож на воск, легко режется ножом. В твёрдом состоянии белый фосфор имеет молекулярную кристаллическую решётку. Формула — Р4.
Способен к хемилюминесценции (при окислении кислородом начинает светиться). При попадании в атмосферу воздуха начинает реагировать с кислородом — самовозгораться. Очень ядовит!
 Рисунок 5. Красный фосфор
Рисунок 5. Красный фосфор
- Красный фосфор
Твёрдое вещество красно-бурого цвета. Менее активен, чем белый фосфор, не токсичен и не светится на воздухе. Горит ярким пламенем с выделением густого белого дыма.
Химические свойства фосфора
Фосфор обладает как окислительными, так и восстановительными свойствами. По отношению к элементам с меньшей, чем у него электроотрицательностью, он окислитель. По отношению к элементам с большей электроотрицательностью он восстановитель.
Окислительные свойства
1. Взаимодействие с металлами
Образуются фосфиды — бинарные соединения, в которых фосфор проявляет степень окисления −3:
.
Фосфиды щелочных и щелочноземельных металлов разлагаются водой с выделением фосфина:
.
Фосфин — летучее водородное соединение фосфора — газ с неприятным запахом испорченной рыбы.
2. Взаимодействие с водородом
При температуре 300–360 °С образуется фосфин:
.
Фосфин самовозгорается на воздухе:
.
Восстановительные свойства
1. Взаимодействие с кислородом:
.
2. Взаимодействие с галогенами:
.
3. Взаимодействие со сложными веществами-окислителями:
.
Образуется фосфорная кислота .
Упражнение 1
Напишите уравнения реакций, с помощью которых можно осуществить следующую цепочку превращений:
.
Соединения фосфора
Из соединений фосфора мы рассмотрим два оксида, одну кислоту и её соли. Начнём с оксидов.
Фосфор образует два оксида: оксид фосфора (III) и оксид фосфора (V).
Оксид фосфора (III) имеет кислотный характер. Представляет собой белое кристаллическое вещество с неприятным запахом. Кислотному оксиду соответствует фосфористая кислота с формулой .
Степень окисления фосфора в кислотном оксиде и соответствующей ему кислоте совпадает.
Оксид фосфора (V) также кислотный. Твёрдый, белого цвета. Данный оксид очень гигроскопичное вещество, то есть способно жадно поглощать водяные пары. Ему соответствует фосфорная кислота , которая образуется при растворении оксида в воде:
.
Также оксид фосфора (V) взаимодействует с щелочами, образуя соли фосфорной кислоты — фосфаты:
.
Перейдём непосредственно к самой фосфорной кислоте.
Фосфорная кислота
Фосфорная кислота имеет ещё одно название — ортофосфорная кислота. Это твёрдое вещество белого цвета. Является очень гигроскопичной, как и её оксид. При продолжительном нахождении на воздухе она превращается в вязкую жидкость.
Ортофосфорная кислота проявляет типичные свойства кислот, реагируя с оксидами и гидроксидами щелочных и щелочноземельных металлов, а также с солями.
Пример 1
Запишите уравнение реакции фосфорной кислоты с оксидом кальция.
Решение
- Оксид кальция — оксид щелочноземельного металла с формулой CaO.
- При взаимодействии оксида и кислоты образуется соль и вода.
- Запишем уравнение реакции:
.
Упражнение 2
Запишите уравнения реакций фосфорной кислоты с гидроксидом натрия и карбонатом калия.
Разбавленную фосфорную кислоту получают обработкой фосфатов раствором серной кислоты:
.
А концентрированную фосфорную кислоту получают, окисляя красный фосфор до оксида фосфора (V), который после растворяют в воде.
Ортофосфорная кислота находит широкое применение в различных областях деятельности человека:
- производство удобрений;
- пищевая промышленность;
- звероводство;
- деревообрабатывающая промышленность;
- производство строительных материалов и бытовой химии;
- соли фосфорной кислоты используются для смягчения воды.
Соли фосфорной кислоты
Все фосфаты — нерастворимые соединения, кроме фосфатов калия и натрия.
Качественная реакций на фосфат ион — взаимодействие фосфорной кислоты или её соли с раствором нитрата серебра. Образуется осадок жёлтого цвета:
.
Для данного сокращенного ионного уравнения запишите молекулярное и полное ионное уравнения:
.
Контрольные вопросы
- Опишите строение атома фосфора. Какие степени окисления проявляет фосфор в соединениях?
- Дайте характеристику оксидам фосфора.
- Охарактеризуйте фосфорную кислоту по химическим свойствам.

