- Оксиды азота
- Азотистая кислота и её соли
- Азотная кислота и её соли
- рассмотреть оксиды азота
- дать характеристику азотистой кислоты и её солей
- охарактеризовать свойства азотной кислоты, рассмотреть особенности взаимодействия азотной кислоты с металлами, отметить области её применения
- Напишите уравнения реакций горения азота. Какие соединения образуются при этом?
- Какие свойства проявляет аммиак и его водный раствор?
- Какие степени окисления способен проявлять азот?
Степени окисления азота весьма разнообразны. Но кислород является более электроотрицательным элементом, поэтому в соединениях с кислородом азот будет проявлять только положительные степени окисления: +1, +2, +3, +4 и +5.
Мы начнём с рассмотрения оксидов азота. Всего их пять.
Оксиды азота
Азот взаимодействует с кислородом только при температуре выше 2 000 °С. При этом образуется оксид азота (II):
.
Оксид азота (II) — это бесцветный газ, он относится к несолеобразующим оксидам, то есть не взаимодействует с кислотами и основаниями с образованием солей.
Кроме данного оксида, азот образует ещё четыре:
- оксид азота (I) — также несолеобразующий оксид;
- оксид азота (III) — кислотный оксид. Ему соответствует азотистая кислота (азот в степени окисления +3, также как в оксиде), она образуется при взаимодействии оксида с водой:
;
- оксид азота (V) — кислотный оксид. Ему соответствует азотная кислота (степень окисления азота +5, как в оксиде):
.
- оксид азота (IV) — кислотный оксид, но не совсем обычный. Азот не образует кислоту, в которой он находился бы в степени окисления +4, как в оксиде. При взаимодействии с водой данный оксид образует две кислоты — азотистую и азотную:
.
Азотистая кислота
Азотистая кислота относится к слабым кислотам. Она легко разлагается, поэтому получить её в свободном состоянии нельзя. В водном растворе она диссоциирует обратимо:
.
В азотной кислоте атом азота находится в промежуточной степени окисления, поэтому она может проявлять как окислительные свойства (слабые), так и восстановительные.
- Кислород — хороший окислитель. Он может окислять азотистую кислоту, которая в этом случае будет проявлять восстановительные свойства:
.
- Слабые окислительные свойства азотистая кислота проявляет с восстановителями, например:
.
- Проявляя обычные кислотные свойства, азотистая кислота взаимодействует с щелочами и основными оксидами с образованием нитритов:
.
Упражнение 1
Запишите уравнения реакций азотистой кислоты с гидроксидом натрия и гидроксидом лития.
Соли азотистой кислоты — нитриты. Представляют собой белые кристаллические вещества. Они уже более устойчивы, чем азотистая кислота, но многие из них токсичны.
Нитрит аммония проявляет интересное свойство. Он разлагается при нагревании с образованием азота:
.
Теперь обсудим одну из самых сильных и необычных по свойствам кислот — азотную.
Азотная кислота
Исходным веществом для получения азотной кислоты служит аммиак. Почему не азот? Как мы уже говорили, азот достаточно инертное вещество, его сложно заставить взаимодействовать с чем-либо из-за тройной связи между атомами в молекуле . Связи в аммиаке не такие прочные, их легко разрушить при окислении, поэтому на производство азотной кислоты из аммиака будет затрачено меньше ресурсов, чем из азота.
Получение азотной кислоты происходит в несколько стадий.
- Для начала окисляют аммиак до оксида азота (II) с использованием катализатора:
.
- Затем оксид азота (II) окисляют кислородом воздуха до оксида азота (IV):
.
- И на последней стадии оксид азота (IV) реагирует с водой. Здесь протекает множество сложный реакций, но упрощённо эта стадия соответствует следующему уравнению реакции:
.
По своим свойствам азотная кислота — сильный электролит, который полностью диссоциирует в водном растворе.
Запишите уравнение диссоциации азотной кислоты. Как будет изменяться цвет индикаторов в растворе данной кислоты?
И так как — типичная кислота, она реагирует с основными и амфотерными оксидами, с щелочами и нерастворимыми гидроксидами металлов, а также с солями.
Пример 1
Будет ли азотная кислота взаимодействовать с оксидом алюминия, с соляной кислотой, сульфатом натрия? Запишите возможные уравнения реакций.
Решение
- Определим, с какими веществами будет реагировать азотная кислота. Оксид алюминия — амфотерный оксид, соляная кислота — кислота, сульфат натрия — соль.
- Зная свойства кислот, предположим, что азотная кислота будет взаимодействовать с оксидом алюминия и с сульфатом натрия.
- Запишем уравнения реакций:
- ;
- . Вспомним, что соли взаимодействуют с кислотами, если выполняется условие необратимости (выделение осадка или газа). В данном случае нет ни осадка, ни газа, поэтому эта реакция протекать не будет;
- Таким образом, из перечисленных веществ азотная кислота будет взаимодействовать только с оксидом алюминия.
Упражнение 2
С какими из перечисленных веществ будет взаимодействовать азотная кислота: оксид углерода (IV), гидроксид бария, оксид меди (II), серная кислота, гидроксид цинка, карбонат кальция. Запишите уравнения возможных реакций.
Особенные свойства азотная кислота проявляет при взаимодействии с металлами. Окислителем в таких реакциях выступает нитрат-ион , поэтому продуктом процесса восстановления будет не водород, а соединения азота в более низких степенях окисления. Как понять, что именно за соединения это будут? Здесь всё будет зависеть от концентрации кислоты и от активности металла. Более подробно особенности взаимодействия металлов с азотной кислотой можно изучить на рисунке 1.
Металлы никогда не вытесняют водород из азотной кислоты.
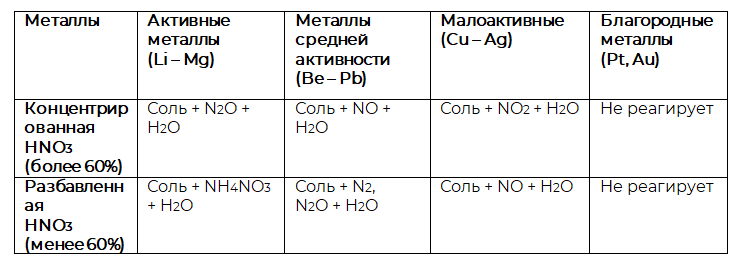 Рисунок 1. Взаимодействие металлов с азотной кислотой
Рисунок 1. Взаимодействие металлов с азотной кислотой
Железо, алюминий и хром пассивируются концентрированной азотной кислотой.
Пример 2
Запишите уравнение реакции концентрированной азотной кислоты с медью.
Решение
- Определим концентрацию кислоты. В условии сказано, что она концентрированная.
- Определим, к какой группе относится металл. Медь в ряду активности стоит после водорода и по рисунку 1 видно, что она относится к неактивным металлам.
- Таким образом, при взаимодействии концентрированной азотной кислоты и меди будет получаться соль, оксид азота (IV) и вода.
- Запишем уравнение реакции, не забывая про коэффициенты:
.
Упражнение 3
Запишите уравнения реакций:
- магний и концентрированная азотная кислота;
- цинк и разбавленная азотная кислота.
Соли азотной кислоты — нитраты. Это твёрдые кристаллические вещества, которые хорошо растворяются в воде. Нитраты щелочных, щелочноземельных металлов и аммония имеют название «селитры».
Стоит обратить внимание на особенности термического разложения нитратов. Состав продуктов разложения будет зависеть от активности металла в составе соли.
|
Нитрат металла
|
нитрит металла + (до )
|
|
оксид металла + + (от до )
|
|
|
металл + + (после )
|
Пример 3
Запишите уравнение реакции разложения нитрата алюминия.
Решение
- Определим активность металла. В ряду активности металлов алюминий находится между магнием и медью. При разложении нитрата алюминия образуется оксид алюминия, окси азота (IV) и кислород.
- Запишем уравнение реакции:
.
Упражнение 4
Запишите уравнения реакций термического разложения нитрата натрия, нитрата цинка и нитрата меди (II).
Контрольные вопросы
- Какие оксиды образует азот? Каким характером они обладают?
- Охарактеризуйте свойства азотистой кислоты.
- В чём заключается особенность взаимодействия азотной кислоты с металлами?

