- Физические свойства солей
- Физические свойства солей
- Химические свойства солей
- Применение солей
- иметь представление о свойствах солей
- уметь составлять реакции с участием средних, кислых и основных солей
- знать области применения солей
В настоящее время известны основные классы веществ: кислоты, основания, оксиды и соли. К солям относятся сложные вещества, в состав которых входят атомы металлов и кислотные остатки. Поскольку разных металлов и кислотных остатков известно много, число образованных ими солей огромно — несколько тысяч.
Так, например, поваренная соль — только одно вещество из огромного класса солей. Но не следует думать, что все они солёные на вкус, окрашены в белый цвет и растворимы в воде. Подавляющее большинство солей обладают совсем другим вкусом. К тому же многие ядовиты. Соли могут быть окрашены в разные цвета. Известны соли, которые, в отличие от поваренной, нерастворимы в воде, например силикаты.
Учёные предполагают, что слово «соль» происходит от слова «Солнце». Дело в том, что под воздействием тёплых солнечных лучей вода некоторых озёр постепенно испаряется, оставляя на дне твёрдое белое вещество. Оно пришлось по вкусу древним людям и прочно вошло в нашу жизнь под названием «соль». Позже это слово стали использовать во множественном числе для обозначения целого класса однотипных веществ, которые вы сейчас изучаете.
Физические свойства солей
Соли могут быть средними (нормальными), основными, кислыми, двойными и смешанными.
При обычных условиях все соли — твёрдые вещества. Многие соли не имеют цвета, но некоторые ионы придают солям характерную окраску. Так, например, ионы меди — голубой цвет, железа — светло-коричневый цвет, никеля — зелёный цвет. Сложные ионы (анионы), также задают цветовой окрас: — жёлтый цвет, — оранжевый цвет, — фиолетовый цвет.
Соли представляют собой сложные вещества, продукты полного или частичного замещения атомов водорода в кислотах металлом или гидроксогрупп оснований кислотным остатком.
Растворимость солей различна. Практически все нитраты, соли натрия, калия, рубидия, цезия и аммония растворимы. Среди сульфидов и фосфатов растворимы только фосфаты и сульфиды щелочных металлов.
Кристаллы разных солей при этом могут различаться по форме. Так, поваренная соль образует кристаллы в форме куба. Чтобы в этом убедиться, достаточно приготовить очень концентрированный раствор хлорида натрия. Через несколько дней вода в тарелке испарится, и в посуде, где находился раствор, образуются кристаллы соли. Они будут иметь идеальную кубическую форму.
Химические свойства солей
Для большинства солей характерны реакции замещения и обмена, а для некоторых — ещё и реакции разложения.
Взаимодействие с металлами
Соли реагируют с металлами по общей схеме: соль + металл → другая соль + другой металл (реакция замещения). Образующиеся в этих реакциях менее активные металлы осаждаются на поверхности более активных металлов в виде рыхлой корочки. Например, если менее активным металлом является жидкая ртуть, она выделяется в виде сплошной блестящей пленки.
При проведении данных реакций следует помнить основные принципы.
- Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений.

- Обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми.
- Металлы не должны взаимодействовать с водой.
Пример 1
Написать реакцию между хлоридом ртути и медью.
Решение
Медь является более активным металлом, чем ртуть, соответственно, будет вытеснять её из растворов солей.
1. Запишем реакцию между хлоридом ртути и медью. Уравниваем и отмечаем растворимость:
.
Р Н Р Н
2. Запишем окислительно-восстановительный процесс этой реакции:
2 1 восстановитель,
2
2 1 окислитель.
3. Расставим коэффициенты: .
Реакции замещения всегда идут по типу окислительно-восстановительных реакций, так как происходит изменение степени окисления металла в связи с его выделением в чистом виде.
Упражнение 1
Составьте формулы солей натрия, кальция и алюминия для следующих кислот: азотной, серной и фосфорной. Дайте им названия. Какие из солей растворимы в воде?
Взаимодействие с кислотами
В предыдущих курсах уже изучены химические свойства кислот и то, что в водных растворах они реагируют с солями, образуя новые кислоты и новые соли. Значит, что если кислоты реагируют с солями, то соли также могут реагировать с кислотами.
Итак, в водных растворах соли реагируют с кислотами по общей схеме: кислота + соль → новая кислота + новая соль (реакция обмена).
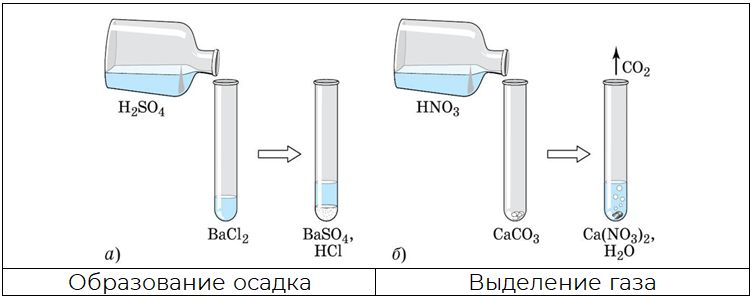
Пример 2
Написать реакцию между раствором азотной кислоты и карбонатом кальция.
Решение
1. Запишем реакцию между раствором азотной кислоты и карбонатом кальция. Уравняем и отметим растворимость:
.
Р Н Р Н Н
При взаимодействии образуется угольная кислота, которая неустойчивая и распадается на углекислый газ и воду.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Аналогично в реакцию вступают кислые и основные соли, которые в результате реакции с растворами кислот проявляют основные свойства и образуют соль и воду:
,
.
При составлении реакций следует помнить, что если в реакцию вступают соль и кислота с одинаковым кислотным остатком, то будет образовываться средняя соль. Если в реакцию вступает соль и кислота с разными кислотными остатками, то в результате реакции образуется смешанная соль.
Кислые соли — это соли, содержащие два вида катионов: катион металла (или аммония) и катион водорода, который даёт к названию приставку «гидро», а также анион кислотного остатка.
Основные соли — это соли, содержащие два вида анионов: кислотный остаток и гидроксогруппа, которая даёт к названию приставку «гидроксо», а также катион металла.
Взаимодействие со щелочами
Реакция растворов солей с растворами щелочей возможна в том случае, когда образующиеся основание или соль выпадают в осадок, выделяются газ или образуется вода.
Реакция идёт по схеме: щелочь + соль → новое основание + новая соль (реакция обмена).
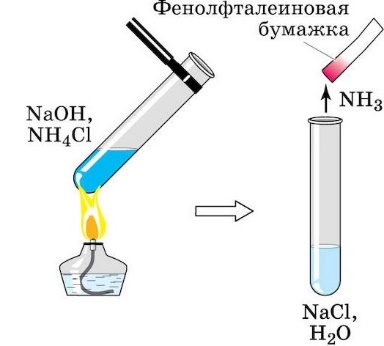
Пример 3
Написать реакцию между раствором хлорида аммония и гидроксидом натрия.
Решение
1. Запишем реакцию между раствором хлорида аммония и гидроксидом натрия. Уравняем и отметим растворимость:
.
Р Р Р Н Н
При взаимодействии образуется гидроксид аммония, который неустойчив и распадается на углекислый газ и воду.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение: .
Аналогично в реакцию вступают кислые соли. Так, взаимодействие гидрохлорида железа (III) с раствором гидроксида калия в результате даёт гидроксид. Продуктом реакции будет гидроксид железа (III), который представляет собой бурый осадок с амфотерными свойствами:
.
Упражнение 2
Из перечисленных формул выпишите формулы: а) оксидов; б) кислот; в) оснований; г) солей. Назовите веществв.
Взаимодействие с солями
Реакция между растворами солей протекают только в том случае, когда одновременно выполняются два требования:
- все исходные соли растворимы;
- в продуктах реакции образуется осадок, газ или вода.
Так, например, сульфат бария не будет реагировать с карбонатом калия, поскольку обе соли нерастворимые, хотя в предполагаемых продуктах реакции есть осадок.
Типичная реакция взаимодействия идет по схеме: соль1 + соль2 → соль3 + соль4 (реакция обмена).
Пример 4
Написать реакцию между раствором нитрата кальция и карбонатом натрия.
Решение
1. Запишем реакцию между нитрата кальция и карбонатом натрия. Уравняем и отметим растворимость:
.
Р Р Н Н
При взаимодействии образуется нерастворимый карбонат кальция.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение: .
Газ при взаимодействии солей образуется в единственном случае — в реакции участвуют раствор нитрата и раствор соли аммония:
.
В результате реакции взаимодействуют ионы и образуют термически неустойчивый нитрит аммония, который разлагается на азот и воду.
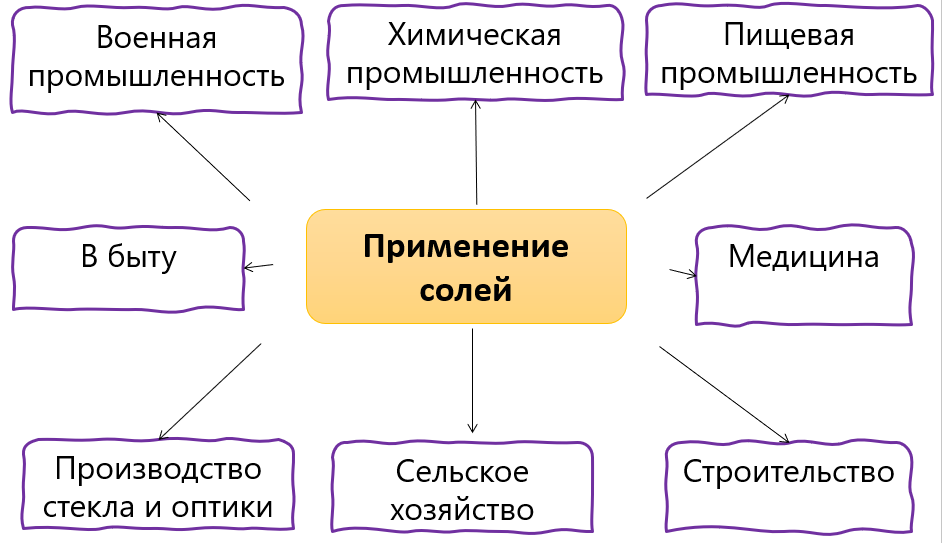
Применение солей
На схеме представлены области применения солей. Так, например, из карбоната кальция наземные животные «строят» свои скелеты — внутреннюю опору для мягких тканей, которые в десятки раз превышают вес самой опоры. А фосфат кальция нерастворимый в воде, — это основа минералов фосфоритов и апатитов. Из них производят фосфорные удобрения, без которых было бы невозможно получение высоких урожаев в сельском хозяйстве. Фосфат кальция также входит в состав костей животных.
Контрольные вопросы
1. Будут ли основные соли взаимодействовать со щелочами?
2. В чём отличие кислых и основных солей?
3. Могут ли органические соли иметь кислотный или основный характер?
4. Какие соли находят применение в быту?
5. В чём отличие применение солей в быту и в пищевой промышленности?
6. Для чего применяются соли в медицине?
Ответы
Упражнение 1
— нитрат натрия, — сульфат натрия, — фосфат натрия;
— нитрат кальция, — сульфат кальция, — фосфат кальция;
— нитрат алюминия, — сульфат алюминия, — фосфат алюминия.
Упражнение 2
а) — оксид серы (VI), — оксид железа (II), — оксид азота (III), — оксид меди (I), — оксид фосфора (V)
б) — сероводородная кислота, — фосфорная кислота
в) — гидроксид калия, — гидроксид железа (III)
г) — сульфит калия, — фосфат меде (II)
- Физические свойства солей
- Физические свойства солей
- Химические свойства солей
- Применение солей
- иметь представление о свойствах солей
- уметь составлять реакции с участием средних, кислых и основных солей
- знать области применения солей
В настоящее время известны основные классы веществ: кислоты, основания, оксиды и соли. К солям относятся сложные вещества, в состав которых входят атомы металлов и кислотные остатки. Поскольку разных металлов и кислотных остатков известно много, число образованных ими солей огромно — несколько тысяч.
Так, например, поваренная соль — только одно вещество из огромного класса солей. Но не следует думать, что все они солёные на вкус, окрашены в белый цвет и растворимы в воде. Подавляющее большинство солей обладают совсем другим вкусом. К тому же многие ядовиты. Соли могут быть окрашены в разные цвета. Известны соли, которые, в отличие от поваренной, нерастворимы в воде, например силикаты.
Учёные предполагают, что слово «соль» происходит от слова «Солнце». Дело в том, что под воздействием тёплых солнечных лучей вода некоторых озёр постепенно испаряется, оставляя на дне твёрдое белое вещество. Оно пришлось по вкусу древним людям и прочно вошло в нашу жизнь под названием «соль». Позже это слово стали использовать во множественном числе для обозначения целого класса однотипных веществ, которые вы сейчас изучаете.
Физические свойства солей
Соли могут быть средними (нормальными), основными, кислыми, двойными и смешанными.
При обычных условиях все соли — твёрдые вещества. Многие соли не имеют цвета, но некоторые ионы придают солям характерную окраску. Так, например, ионы меди — голубой цвет, железа — светло-коричневый цвет, никеля — зелёный цвет. Сложные ионы (анионы), также задают цветовой окрас: — жёлтый цвет, — оранжевый цвет, — фиолетовый цвет.
Соли представляют собой сложные вещества, продукты полного или частичного замещения атомов водорода в кислотах металлом или гидроксогрупп оснований кислотным остатком.
Растворимость солей различна. Практически все нитраты, соли натрия, калия, рубидия, цезия и аммония растворимы. Среди сульфидов и фосфатов растворимы только фосфаты и сульфиды щелочных металлов.
Кристаллы разных солей при этом могут различаться по форме. Так, поваренная соль образует кристаллы в форме куба. Чтобы в этом убедиться, достаточно приготовить очень концентрированный раствор хлорида натрия. Через несколько дней вода в тарелке испарится, и в посуде, где находился раствор, образуются кристаллы соли. Они будут иметь идеальную кубическую форму.
Химические свойства солей
Для большинства солей характерны реакции замещения и обмена, а для некоторых — ещё и реакции разложения.
Взаимодействие с металлами
Соли реагируют с металлами по общей схеме: соль + металл → другая соль + другой металл (реакция замещения). Образующиеся в этих реакциях менее активные металлы осаждаются на поверхности более активных металлов в виде рыхлой корочки. Например, если менее активным металлом является жидкая ртуть, она выделяется в виде сплошной блестящей пленки.
При проведении данных реакций следует помнить основные принципы.
- Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений.

- Обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми.
- Металлы не должны взаимодействовать с водой.
Пример 1
Написать реакцию между хлоридом ртути и медью.
Решение
Медь является более активным металлом, чем ртуть, соответственно, будет вытеснять её из растворов солей.
1. Запишем реакцию между хлоридом ртути и медью. Уравниваем и отмечаем растворимость:
.
Р Н Р Н
2. Запишем окислительно-восстановительный процесс этой реакции:
2 1 восстановитель,
2
2 1 окислитель.
3. Расставим коэффициенты: .
Реакции замещения всегда идут по типу окислительно-восстановительных реакций, так как происходит изменение степени окисления металла в связи с его выделением в чистом виде.
Упражнение 1
Составьте формулы солей натрия, кальция и алюминия для следующих кислот: азотной, серной и фосфорной. Дайте им названия. Какие из солей растворимы в воде?
Взаимодействие с кислотами
В предыдущих курсах уже изучены химические свойства кислот и то, что в водных растворах они реагируют с солями, образуя новые кислоты и новые соли. Значит, что если кислоты реагируют с солями, то соли также могут реагировать с кислотами.
Итак, в водных растворах соли реагируют с кислотами по общей схеме: кислота + соль → новая кислота + новая соль (реакция обмена).

Пример 2
Написать реакцию между раствором азотной кислоты и карбонатом кальция.
Решение
1. Запишем реакцию между раствором азотной кислоты и карбонатом кальция. Уравняем и отметим растворимость:
.
Р Н Р Н Н
При взаимодействии образуется угольная кислота, которая неустойчивая и распадается на углекислый газ и воду.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Аналогично в реакцию вступают кислые и основные соли, которые в результате реакции с растворами кислот проявляют основные свойства и образуют соль и воду:
,
.
При составлении реакций следует помнить, что если в реакцию вступают соль и кислота с одинаковым кислотным остатком, то будет образовываться средняя соль. Если в реакцию вступает соль и кислота с разными кислотными остатками, то в результате реакции образуется смешанная соль.
Кислые соли — это соли, содержащие два вида катионов: катион металла (или аммония) и катион водорода, который даёт к названию приставку «гидро», а также анион кислотного остатка.
Основные соли — это соли, содержащие два вида анионов: кислотный остаток и гидроксогруппа, которая даёт к названию приставку «гидроксо», а также катион металла.
Взаимодействие со щелочами
Реакция растворов солей с растворами щелочей возможна в том случае, когда образующиеся основание или соль выпадают в осадок, выделяются газ или образуется вода.
Реакция идёт по схеме: щелочь + соль → новое основание + новая соль (реакция обмена).

Пример 3
Написать реакцию между раствором хлорида аммония и гидроксидом натрия.
Решение
1. Запишем реакцию между раствором хлорида аммония и гидроксидом натрия. Уравняем и отметим растворимость:
.
Р Р Р Н Н
При взаимодействии образуется гидроксид аммония, который неустойчив и распадается на углекислый газ и воду.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение: .
Аналогично в реакцию вступают кислые соли. Так, взаимодействие гидрохлорида железа (III) с раствором гидроксида калия в результате даёт гидроксид. Продуктом реакции будет гидроксид железа (III), который представляет собой бурый осадок с амфотерными свойствами:
.
Упражнение 2
Из перечисленных формул выпишите формулы: а) оксидов; б) кислот; в) оснований; г) солей. Назовите веществв.
Взаимодействие с солями
Реакция между растворами солей протекают только в том случае, когда одновременно выполняются два требования:
- все исходные соли растворимы;
- в продуктах реакции образуется осадок, газ или вода.
Так, например, сульфат бария не будет реагировать с карбонатом калия, поскольку обе соли нерастворимые, хотя в предполагаемых продуктах реакции есть осадок.
Типичная реакция взаимодействия идет по схеме: соль1 + соль2 → соль3 + соль4 (реакция обмена).
Пример 4
Написать реакцию между раствором нитрата кальция и карбонатом натрия.
Решение
1. Запишем реакцию между нитрата кальция и карбонатом натрия. Уравняем и отметим растворимость:
.
Р Р Н Н
При взаимодействии образуется нерастворимый карбонат кальция.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение: .
Газ при взаимодействии солей образуется в единственном случае — в реакции участвуют раствор нитрата и раствор соли аммония:
.
В результате реакции взаимодействуют ионы и образуют термически неустойчивый нитрит аммония, который разлагается на азот и воду.
Применение солей
На схеме представлены области применения солей. Так, например, из карбоната кальция наземные животные «строят» свои скелеты — внутреннюю опору для мягких тканей, которые в десятки раз превышают вес самой опоры. А фосфат кальция нерастворимый в воде, — это основа минералов фосфоритов и апатитов. Из них производят фосфорные удобрения, без которых было бы невозможно получение высоких урожаев в сельском хозяйстве. Фосфат кальция также входит в состав костей животных.

Контрольные вопросы
1. Будут ли основные соли взаимодействовать со щелочами?
2. В чём отличие кислых и основных солей?
3. Могут ли органические соли иметь кислотный или основный характер?
4. Какие соли находят применение в быту?
5. В чём отличие применение солей в быту и в пищевой промышленности?
6. Для чего применяются соли в медицине?
Ответы
Упражнение 1
— нитрат натрия, — сульфат натрия, — фосфат натрия;
— нитрат кальция, — сульфат кальция, — фосфат кальция;
— нитрат алюминия, — сульфат алюминия, — фосфат алюминия.
Упражнение 2
а) — оксид серы (VI), — оксид железа (II), — оксид азота (III), — оксид меди (I), — оксид фосфора (V)
б) — сероводородная кислота, — фосфорная кислота
в) — гидроксид калия, — гидроксид железа (III)
г) — сульфит калия, — фосфат меде (II)



