- Физические свойства кислот
- Химические свойства кислот
- Получение кислот
- Применение кислот
- понимать, чем обусловлены физические и химические свойства кислот
- знать особенности химических реакций кислот
- уметь составлять реакции с кислотами
- знать способы получения кислот и уметь составлять соответствующие реакции
 Рисунок 1. К. Шееле
Рисунок 1. К. Шееле
Кислоты являются одними из самых распространённых соединений. Например, ещё в X веке алхимикам удалось получить серную кислоту при прокаливании солей — сульфатов (купоросов). Но это установлено не совсем точно. По крайней мере человечество с ней знакомо около тысячи лет. Отсюда произошло историческое название серной кислоты — купоросное масло. Именно под таким названием серная кислота была известна в России.
С органическими кислотами знакомство состоялось несколько позже. Так, благодаря работам известного шведского химика Карла Вильгельма Шееле к концу XVIII века стало известно около десяти различных органических кислот. Он выделил и описал щавелевую, лимонную, молочную и другие кислоты.
Физические свойства кислот
Общая формула кислот где n — число атомов водорода, равное заряду иона кислотного остатка, — кислотный остаток.
Сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка, являются кислотами.
Многие кислоты, например серная, азотная, соляная, — бесцветные жидкости.
Также известны твёрдые кислоты: ортофосфорная метафосфорная борная
Почти все кислоты растворимы в воде. Существует и нерастворимая кислота — кремниевая
Органические (карбоновые) кислоты имеют тоже свои особенности. В жидком состоянии и в растворах молекулы карбоновых кислот образуют межмолекулярные водородные связи, которые вызывают притяжение и ассоциацию молекул карбоновых кислот. Таким образом молекулы карбоновых кислот с помощью водородных связей соединены в димеры.
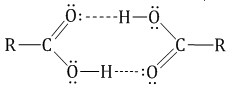
Это приводит к увеличению растворимости в воде и высоким температурам кипения низших карбоновых кислот.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Химические свойства кислот
Исходя из теории электролитической диссоциации, можно утверждать, что кислоты — электролиты, при диссоциации которых в качестве катионов образуются катионы водорода: .
Взаимодействие с основаниями
Кислоты способны реагировать как с растворимыми, так и с нерастворимыми основаниями. С растворимыми основаниями (щелочами) будет протекать реакция нейтрализации, а с нерастворимыми — растворение осадка. Обе реакции будут протекать по типу ионного обмена.
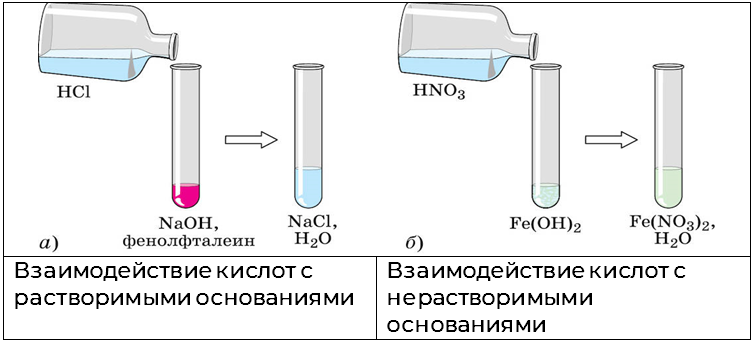
Пример 1
Написать реакцию растворения гидроксида железа (II).
Решение
1. Запишем реакцию между азотной кислотой и гидроксидом железа (II). Уравняем и отметим растворимость:
.
Р Н Р Н
При составлении уравнений следует помнить, что реагирующая кислота и образующаяся соль должны быть растворимы.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Взаимодействие с металлами
Кислоты взаимодействуют и с металлами. При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота разбавленная серная кислота фосфорная кислота плавиковая кислота бромоводородная и йодоводородная кислоты
Здесь следует помнить, что в реакцию с минеральными кислотами вступают только металлы до водорода в ряду активности.

Пример 2
Написать уравнение реакции образования сульфата цинка.
Решение
1. Запишем реакцию между цинком и раствором серной кислотой:
.
2. Запишем окислительно-восстановительный процесс этой реакции:
2 1 восстановитель,
2
2 1 окислитель,
3. Расставим коэффициенты: .
Взаимодействие с солями
Кислоты взаимодействуют с солями, но только в том случае, если в ходе реакции происходит образование газообразного вещества, малорастворимого или нерастворимого соединения, воды.
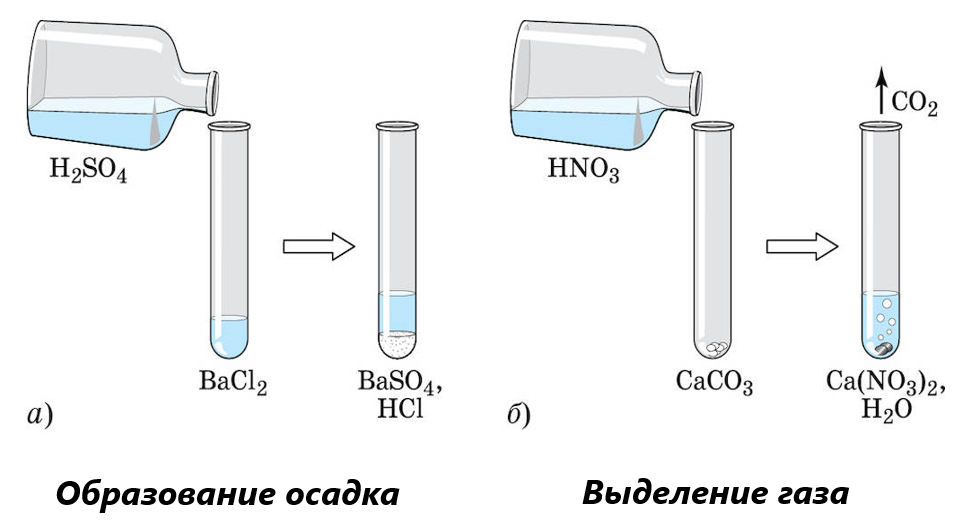
Пример 3
Написать реакцию образования сульфата бария.
Решение
1. Запишем реакцию между раствором серной кислоты и хлоридом бария. Уравняем и отметим растворимость:
.
Р Р Н Р
При составлении уравнений следует помнить, что должен образоваться осадок, газ или вода. В данном случае выпадает осадок.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Получение кислот
Существует три наиболее распространённых метода получения кислот. Все они связаны с протекающими химическими реакциями.
Например, бескислородные кислоты получают при растворении в воде газообразных соединений неметаллов с водородом. Так, например, соляная кислота образуется в результате растворения газа хлороводорода в воде, а сероводородная кислота образуется при растворении газа сероводорода в воде. А вот газообразные соединения можно получить в реакциях соединения водорода с соответствующими неметаллами:
.
Также кислородсодержащие кислоты можно получить взаимодействием соответствующих кислотных оксидов с водой:
.
Кислоты можно получить из соответствующих солей. Реакции обмена протекают в соответствии с вытеснительным рядом кислот, в котором каждая последующая слабее предыдущей.

Так, например, соляная кислота вытесняет уксусную из растворов её солей, а фосфорная кислота может быть вытеснена серной:
.
Упражнение 1
Какими способом можно получить серную кислоту? Напишите уравнение реакции.
Применение кислот
Из всех кислот наиболее широкую сферу применения нашли уксусная, соляная, серная, ортофосфорная и азотная кислоты. Их используют в качестве сырья для получения различного спектра веществ — других кислот, солей, удобрений, красителей, взрывчатых веществ, лаков и красок. Разбавленные соляную, ортофосфорную и борную кислоты используют в медицине.
Также кислоты нашли широкое применение в быту, они известны нам как уксусная и лимонная, а также кислоты входят в состав чистящих средств.
Контрольные вопросы
1. Почему кремниевая кислота не реагирует с металлами в чистом виде?
2. При взаимодействии с какими металлами концентрированная серная кислота их пассивирует? Почему?
3. Какие кислоты встречаются в природе?
4. Какие органические кислоты вы помните с курса 10-го класса?
Ответы
Упражнение 1
- Физические свойства кислот
- Химические свойства кислот
- Получение кислот
- Применение кислот
- понимать, чем обусловлены физические и химические свойства кислот
- знать особенности химических реакций кислот
- уметь составлять реакции с кислотами
- знать способы получения кислот и уметь составлять соответствующие реакции
 Рисунок 1. К. Шееле
Рисунок 1. К. Шееле
Кислоты являются одними из самых распространённых соединений. Например, ещё в X веке алхимикам удалось получить серную кислоту при прокаливании солей — сульфатов (купоросов). Но это установлено не совсем точно. По крайней мере человечество с ней знакомо около тысячи лет. Отсюда произошло историческое название серной кислоты — купоросное масло. Именно под таким названием серная кислота была известна в России.
С органическими кислотами знакомство состоялось несколько позже. Так, благодаря работам известного шведского химика Карла Вильгельма Шееле к концу XVIII века стало известно около десяти различных органических кислот. Он выделил и описал щавелевую, лимонную, молочную и другие кислоты.
Физические свойства кислот
Общая формула кислот где n — число атомов водорода, равное заряду иона кислотного остатка, — кислотный остаток.
Сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка, являются кислотами.
Многие кислоты, например серная, азотная, соляная, — бесцветные жидкости.
Также известны твёрдые кислоты: ортофосфорная метафосфорная борная
Почти все кислоты растворимы в воде. Существует и нерастворимая кислота — кремниевая
Органические (карбоновые) кислоты имеют тоже свои особенности. В жидком состоянии и в растворах молекулы карбоновых кислот образуют межмолекулярные водородные связи, которые вызывают притяжение и ассоциацию молекул карбоновых кислот. Таким образом молекулы карбоновых кислот с помощью водородных связей соединены в димеры.
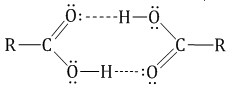
Это приводит к увеличению растворимости в воде и высоким температурам кипения низших карбоновых кислот.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Химические свойства кислот
Исходя из теории электролитической диссоциации, можно утверждать, что кислоты — электролиты, при диссоциации которых в качестве катионов образуются катионы водорода: .
Взаимодействие с основаниями
Кислоты способны реагировать как с растворимыми, так и с нерастворимыми основаниями. С растворимыми основаниями (щелочами) будет протекать реакция нейтрализации, а с нерастворимыми — растворение осадка. Обе реакции будут протекать по типу ионного обмена.

Пример 1
Написать реакцию растворения гидроксида железа (II).
Решение
1. Запишем реакцию между азотной кислотой и гидроксидом железа (II). Уравняем и отметим растворимость:
.
Р Н Р Н
При составлении уравнений следует помнить, что реагирующая кислота и образующаяся соль должны быть растворимы.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Взаимодействие с металлами
Кислоты взаимодействуют и с металлами. При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота разбавленная серная кислота фосфорная кислота плавиковая кислота бромоводородная и йодоводородная кислоты
Здесь следует помнить, что в реакцию с минеральными кислотами вступают только металлы до водорода в ряду активности.

Пример 2
Написать уравнение реакции образования сульфата цинка.
Решение
1. Запишем реакцию между цинком и раствором серной кислотой:
.
2. Запишем окислительно-восстановительный процесс этой реакции:
2 1 восстановитель,
2
2 1 окислитель,
3. Расставим коэффициенты: .
Взаимодействие с солями
Кислоты взаимодействуют с солями, но только в том случае, если в ходе реакции происходит образование газообразного вещества, малорастворимого или нерастворимого соединения, воды.

Пример 3
Написать реакцию образования сульфата бария.
Решение
1. Запишем реакцию между раствором серной кислоты и хлоридом бария. Уравняем и отметим растворимость:
.
Р Р Н Р
При составлении уравнений следует помнить, что должен образоваться осадок, газ или вода. В данном случае выпадает осадок.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Получение кислот
Существует три наиболее распространённых метода получения кислот. Все они связаны с протекающими химическими реакциями.
Например, бескислородные кислоты получают при растворении в воде газообразных соединений неметаллов с водородом. Так, например, соляная кислота образуется в результате растворения газа хлороводорода в воде, а сероводородная кислота образуется при растворении газа сероводорода в воде. А вот газообразные соединения можно получить в реакциях соединения водорода с соответствующими неметаллами:
.
Также кислородсодержащие кислоты можно получить взаимодействием соответствующих кислотных оксидов с водой:
.
Кислоты можно получить из соответствующих солей. Реакции обмена протекают в соответствии с вытеснительным рядом кислот, в котором каждая последующая слабее предыдущей.

Так, например, соляная кислота вытесняет уксусную из растворов её солей, а фосфорная кислота может быть вытеснена серной:
.
Упражнение 1
Какими способом можно получить серную кислоту? Напишите уравнение реакции.
Применение кислот
Из всех кислот наиболее широкую сферу применения нашли уксусная, соляная, серная, ортофосфорная и азотная кислоты. Их используют в качестве сырья для получения различного спектра веществ — других кислот, солей, удобрений, красителей, взрывчатых веществ, лаков и красок. Разбавленные соляную, ортофосфорную и борную кислоты используют в медицине.

Также кислоты нашли широкое применение в быту, они известны нам как уксусная и лимонная, а также кислоты входят в состав чистящих средств.
Контрольные вопросы
1. Почему кремниевая кислота не реагирует с металлами в чистом виде?
2. При взаимодействии с какими металлами концентрированная серная кислота их пассивирует? Почему?
3. Какие кислоты встречаются в природе?
4. Какие органические кислоты вы помните с курса 10-го класса?
Ответы
Упражнение 1



