- Основные понятия о дисперсных системах
- Классификация дисперсных систем
- Свойства коллоидных систем
- знать понятия: дисперсные системы, дисперсная фаза, дисперсионная среда, коллоидная химия, синерезис, коагуляция
- уметь приводить примеры дисперсных систем; классифицировать дисперсные системы
Разминка
 Рис. 1. Египтяне добывают твёрдые породы
Рис. 1. Египтяне добывают твёрдые породы
Холодный утренний туман, оседающий на землю, причудливой формы облака, столб дыма над костром, взвешенные частицы в воде рек и ручьев — всё это мы видели множество раз, нас постоянно окружают дисперсные системы.
Ещё в глубокой древности человек использовал дисперсные процессы. Египтяне забивали в щели скал деревянные клинья и поливали их водой. Древесина набухала, создавалось огромное давление, которое разрушало самые твёрдые скальные породы.
Основные понятия о дисперсных системах
Дисперсные системы — это системы, в которых одно вещество равномерно распределено в виде частиц внутри другого вещества.
Раздробленное вещество называется дисперсной фазой. Однородное вещество, в котором распределена дисперсная фаза, называется дисперсионной средой.
Например: вода, содержащая глину (частички глины — дисперсная фаза; вода — дисперсионная среда); туман (частички жидкости — дисперсная фаза, воздух — дисперсионная среда); молоко (частички жира — дисперсная фаза, жидкость — дисперсионная среда).
Свойства веществ в дисперсном состоянии значительно отличаются от свойств того же вещества, находящегося в недисперсном состоянии. То есть в виде куска твёрдого тела или некоторого объёма жидкости. Например, золото в соляной кислоте не растворяется, но в высокодисперсном состоянии легко переходит в раствор.
Область химической науки, которая занимается изучением дисперсных систем и поверхностных явлений, называется коллоидной химией.
В дисперсном состоянии может быть любое вещество неорганического и органического происхождения. Поэтому коллоидная химия — это общая связующая основа многих областей науки.
Однако коллоидная химия выделена как самостоятельная научная дисциплина и является примером науки, объединяющей химические и физические подходы к изучению природных (в данном случае коллоидных) явлений.
Пример 1
Определите дисперсные системы:
1) хлеб, 4) шоколад,
2) дистиллированная вода, 5) крем,
3) воздух, 6) природный газ.
Решение
Рассмотрим каждый из вариантов, опираясь на определение дисперсной системы.
1. В дисперсной системе должно быть «раздробленное вещество», которое распределено внутри однородного.
2. Рассмотрим первый вариант — хлеб. К данному определению хлеб подходит, так как, например, дрожжи и мука равномерно распределяются внутри исходной жидкой фазы — молока или воды.
3. Дистиллированная вода не подходит под определение дисперсного раствора, так как в ней отсутствует растворённое вещество.
4. Воздух — смесь газов, в которой преобладают кислород и азот, также не подходит под определение дисперсной системы.
5. Шоколад — смесь, которая сочетает какао-масло, в котором растворены частички какао и сахара. Данная система подходит под определение и является дисперсной.
6. Крем — смесь двух жидких фаз, одна из которых равномерно распределена в другой. Например глицерин растворяется в основной субстанции крема. Данная система подходит под определение и является дисперсной.
7. Природный газ — смесь компонентов только газовой фазы, что не подходит под определение.
Ответ: 1, 4, 5.
Классификация дисперсных систем
Существует несколько классификаций дисперсных систем:
- по размеру частиц (по степени дисперсности, раздробленности);
- по агрегатному состоянию дисперсной фазы и дисперсионной среды;
- по наличию или отсутствию взаимодействия между частицами дисперсной фазы;
- по интенсивности взаимодействия частиц дисперсной фазы с молекулами дисперсионной среды;
- по термодинамической и кинетической устойчивости дисперсных систем и т. д.
Классификация дисперсных систем по размеру частиц
Количественной характеристикой дисперсности вещества является степень дисперсности (D). Численно она равна числу частиц, которые можно плотно уложить в ряд (или стопку) на протяжении одного сантиметра.
Условно принятые границы размеров частиц с различной степенью раздробленности:
1) грубодисперсные (суспензии, эмульсии, порошки) — размер частиц больше 100 нм;
2) высокодисперсные (коллоидные растворы) — размер частиц от 1 до
100 нм;
3) истинные растворы (водные растворы кислот, щелочей, солей, одноатомных и многоатомных спиртов) — размер частиц меньше 1 нм.
Если все частицы дисперсной фазы имеют одинаковые размеры, то такие системы называют монодисперсными.
Частицы дисперсной фазы разного размера образуют полидисперсные системы. В реальных дисперсных системах частицы имеют различные размеры.
Классификация дисперсных систем по агрегатному состоянию (табл. 1).
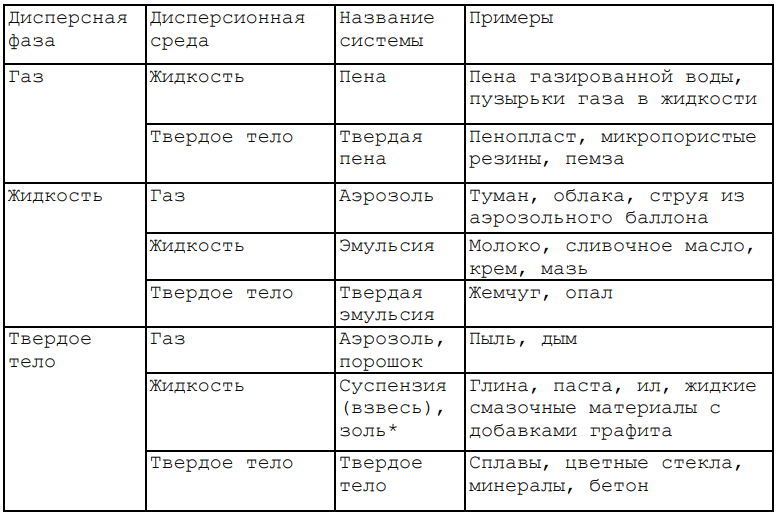 Таблица 1. Типы дисперсных систем
Таблица 1. Типы дисперсных систем
*Чтобы подчеркнуть, что дисперсионной средой является жидкость, их называют лиозолями (от греч. «лиос» — жидкость). Если дисперсионной средой является вода, такие золи называют гидрозолями. Если органическая жидкость — органозолями.
Классификация дисперсных систем по наличию или отсутствию взаимодействия между частицами дисперсной фазы.
Свободнодисперсные. В этих системах частицы дисперсной фазы не имеют контактов, участвуют в беспорядочном тепловом движении, свободно перемещаются под действием силы тяжести. Такие системы текучи.
К свободнодисперсным системам относятся:
— аэрозоли;
— лизоли;
— разбавленные суспензии и эмульсии.
Связнодисперсные. Возникают при контакте частиц дисперсной фазы, которые приводят к образованию структуры в виде каркаса или скелета. Эта структура ограничивает текучесть дисперсионной среды и придаёт ей способность сохранять форму. Именно поэтому связнодисперсные системы твёрдообразные. Подобные структурированные коллоидные системы называются гелями.
К связнодисперсным системам относятся:
- порошки;
- концентрированные эмульсии и суспензии (пасты);
- пены;
- почва, т. к. она образовалась в результате контакта и уплотнения дисперсных частиц почвенных минералов и гумусовых (органических) веществ.
Сплошную массу вещества могут пронизывать поры и капилляры, образующие капиллярнодисперсные системы. К ним относятся: древесина, разнообразные мембраны и диафрагмы, кожа, бумага, картон, ткань.
Пример 2
Установите соответствие между дисперсной системой и её классификацией по агрегатному состоянию. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
| ДИСПЕРСНАЯ СИСТЕМА | КЛАССИФИКАЦИЯ |
| A) туман | 1) твёрдое в твёрдом |
| Б) сплавы | 2) жидкость в жидкости |
| B) эмульсии | 3) жидкость в газе |
| Г) золи | 4) газ в жидкости |
| 5) твёрдое в жидкости | |
| 6) твёрдое в газе |
Решение
Рассмотрим каждую из представленных систем.
1. Туман — это газовая смесь, внутри которой распределены капельки жидкости. Это подходит под определение дисперсной системы «жидкость в газе».
2. Сплавы — смесь из двух металлов, где один металл распределён внутри другого. Это подходит под определение дисперсной системы «твёрдое в твёрдом».
3. Эмульсии — смесь двух жидкостей, в которой мельчайшие частички одной из них распределены внутри другой. Это подходит под определение дисперсной системы «жидкость в жидкости».
4. Золи — сложные смеси, в основе которых лежит жидкая или газообразная фаза, внутри которой распределены пузырьки другой жидкости или газа. Это подходит под определение дисперсной системы «твёрдое в жидкости».
Ответ: 3, 1, 2, 5.
Упражнение 1
1. Плазма крови представляет собой дисперсную систему:
1) жидкость в твердом веществе,
2) твёрдое вещество в жидкости,
3) газ в жидкости,
4) жидкость в жидкости.
2. Природной эмульсией является:
1) хрящи,
2) облака,
3) воздух,
4) нефть.
Свойства коллоидных систем
Оптические свойства коллоидных систем
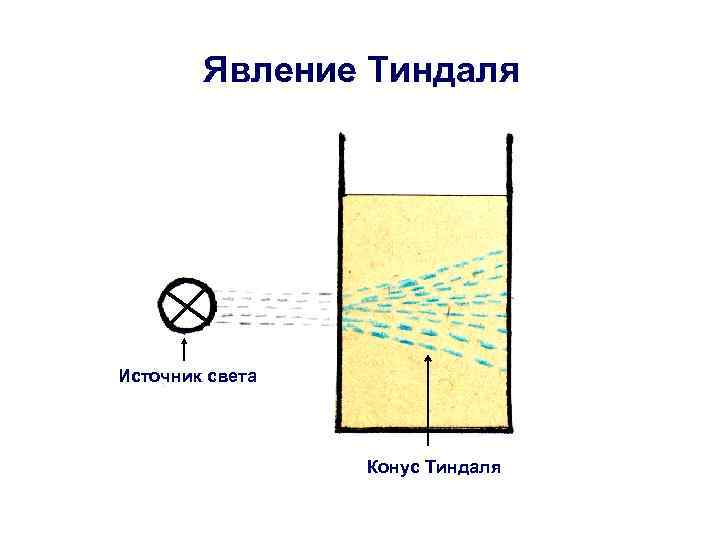 Рис. 2. Явление Тиндаля
Рис. 2. Явление Тиндаля
Коллоидные системы обладают способностью светорассеивания.
Взаимодействие света с веществом зависит от соотношения длины волны света и размеров частиц, на которые падает световой поток. Если размеры частицы больше длины волны, происходит отражение или преломление света. Если размеры частицы меньше половины длины волны падающего света, происходит рассеивание света в результате дифракции.
Размеры коллоидной частицы меньше половины длины волны падающего света. Поэтому коллоидные частицы не отражают, а рассеивают свет (явление опалесценции).
Светорассеивание характерно и для истинных растворов. Но только в коллоидных системах можно наблюдать явление Тиндаля: при боковом рассмотрении коллоидного раствора, через который проходит световой луч, внутри коллоидной системы наблюдается светящийся конус.
Молекулярно-кинетические свойства коллоидных систем
Молекулярно-кинетические свойства — это те свойства, которые связаны хаотическим тепловым движением частиц, образующих те или иные системы.
К молекулярно-кинетические свойствам дисперсных систем относят: броуновское движение, диффузию, седиментацию.
Броуновское движение — беспорядочное, хаотичное (подобно рою комаров) движение частиц. Это явление получило название по имени Р. Броуна, который в 1827 г. обнаружил под микроскопом непрерывные колебательные движения пыльцы растений в её взвеси с водой.
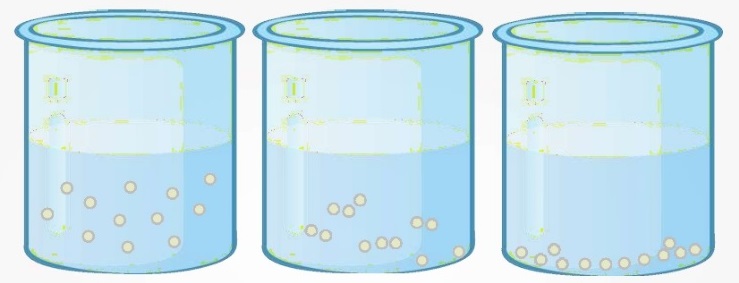 Рис. 3. Седиментация
Рис. 3. Седиментация
Седиментация — осаждение частиц дисперсной фазы под действием силы тяжести.
Седиментируют только достаточно крупные частицы. Например, частицы кварца размером 5 • 103 нм оседают в воде за 3 ч на 3 см. Седиментации частиц размером 103 нм и менее препятствует броуновское движение.
Синерезис представляет собой самопроизвольное уменьшение объёма студней или гелей, которое сопровождается отделением жидкости — дисперсионной среды.
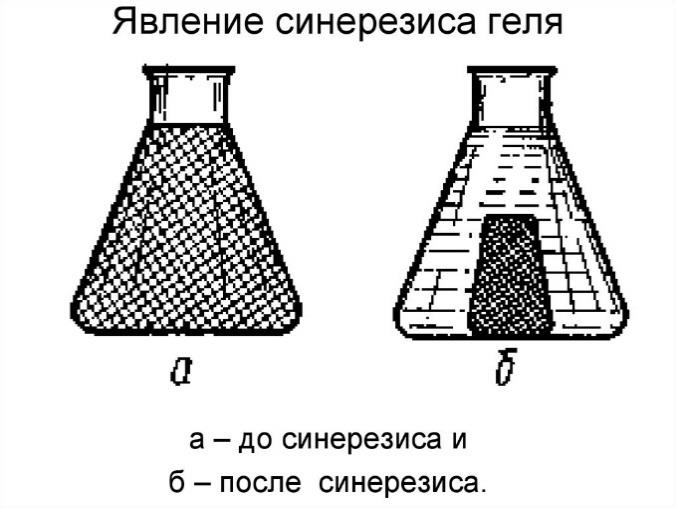 Рис. 4. Синерезис геля
Рис. 4. Синерезис геля
Коагуля́ция представляет собой слипание частиц коллоидной системы при их столкновениях в процессе теплового (броуновского) движения, перемешивания или направленного перемещения во внешнем силовом поле. В результате коагуляции происходит образование более крупных частиц — агрегатов, которые являются вторичными и состоят из скопления более мелких, то есть первичных частиц.
Пример 3
Установите соответствие между явлением и его описанием. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
| ЯВЛЕНИЕ | ОПИСАНИЕ ЯВЛЕНИЯ |
| А) коагуляция | 1) образование конуса «светящейся дорожки» при пропускании через коллоидный раствор луча света |
| Б) синерезис | 2) слипание коллоидных частиц и выпадение их в осадок |
| В) эффект Тиндаля | 3) самопроизвольное уменьшение объёма геля, сопровождающееся отделением жидкости |
Решение
Рассмотрим представленные явления.
1. Коагуляция представляет собой сгущение частиц, то есть слипание коллоидных частиц с их последующим выпадением в осадок.
2. Синерезис представляет собой уменьшение объёма, например геля, и выделение жидкости, которая является дисперсной средой.
3. Эффект Тиндаля — при прохождении света через неоднородную среду происходит его конусообразно рассеивание.
Ответ: 2, 3, 1.
Упражнение 2
1. Наименьшие частицы дисперсной фазы:
1) в истинных растворах,
2) в коллоидных растворах,
3) во взвесях,
4) в механических смесях.
2. Свёртывание крови — это явление
1) коагуляции, 2) денатурации,
3) осаждения, 4) синерезиса.
Контрольные вопросы
- Что такое дисперсные системы? Чем они отличаются от других смесей и от истинных растворов?
- Какие типы дисперсных систем выделяют по агрегатному состоянию и по дисперсной фазе? Приведите примеры природных и бытовых дисперсных систем каждого типа.
- Какой процесс называется коагуляцией? Какими факторами она может быть спровоцирована?
- Какой процесс называется синерезисом? Какое значение имеет синерезис в пищевой и медицинской промышленности?
Ответы
Упражнение 1
1) 4
2) 4
Упражнение 2
1) 1
2) 1, 4
- Основные понятия о дисперсных системах
- Классификация дисперсных систем
- Свойства коллоидных систем
- знать понятия: дисперсные системы, дисперсная фаза, дисперсионная среда, коллоидная химия, синерезис, коагуляция
- уметь приводить примеры дисперсных систем; классифицировать дисперсные системы
Разминка
 Рис. 1. Египтяне добывают твёрдые породы
Рис. 1. Египтяне добывают твёрдые породы
Холодный утренний туман, оседающий на землю, причудливой формы облака, столб дыма над костром, взвешенные частицы в воде рек и ручьев — всё это мы видели множество раз, нас постоянно окружают дисперсные системы.
Ещё в глубокой древности человек использовал дисперсные процессы. Египтяне забивали в щели скал деревянные клинья и поливали их водой. Древесина набухала, создавалось огромное давление, которое разрушало самые твёрдые скальные породы.
Основные понятия о дисперсных системах
Дисперсные системы — это системы, в которых одно вещество равномерно распределено в виде частиц внутри другого вещества.
Раздробленное вещество называется дисперсной фазой. Однородное вещество, в котором распределена дисперсная фаза, называется дисперсионной средой.
Например: вода, содержащая глину (частички глины — дисперсная фаза; вода — дисперсионная среда); туман (частички жидкости — дисперсная фаза, воздух — дисперсионная среда); молоко (частички жира — дисперсная фаза, жидкость — дисперсионная среда).
Свойства веществ в дисперсном состоянии значительно отличаются от свойств того же вещества, находящегося в недисперсном состоянии. То есть в виде куска твёрдого тела или некоторого объёма жидкости. Например, золото в соляной кислоте не растворяется, но в высокодисперсном состоянии легко переходит в раствор.
Область химической науки, которая занимается изучением дисперсных систем и поверхностных явлений, называется коллоидной химией.
В дисперсном состоянии может быть любое вещество неорганического и органического происхождения. Поэтому коллоидная химия — это общая связующая основа многих областей науки.
Однако коллоидная химия выделена как самостоятельная научная дисциплина и является примером науки, объединяющей химические и физические подходы к изучению природных (в данном случае коллоидных) явлений.
Пример 1
Определите дисперсные системы:
1) хлеб, 4) шоколад,
2) дистиллированная вода, 5) крем,
3) воздух, 6) природный газ.
Решение
Рассмотрим каждый из вариантов, опираясь на определение дисперсной системы.
1. В дисперсной системе должно быть «раздробленное вещество», которое распределено внутри однородного.
2. Рассмотрим первый вариант — хлеб. К данному определению хлеб подходит, так как, например, дрожжи и мука равномерно распределяются внутри исходной жидкой фазы — молока или воды.
3. Дистиллированная вода не подходит под определение дисперсного раствора, так как в ней отсутствует растворённое вещество.
4. Воздух — смесь газов, в которой преобладают кислород и азот, также не подходит под определение дисперсной системы.
5. Шоколад — смесь, которая сочетает какао-масло, в котором растворены частички какао и сахара. Данная система подходит под определение и является дисперсной.
6. Крем — смесь двух жидких фаз, одна из которых равномерно распределена в другой. Например глицерин растворяется в основной субстанции крема. Данная система подходит под определение и является дисперсной.
7. Природный газ — смесь компонентов только газовой фазы, что не подходит под определение.
Ответ: 1, 4, 5.
Классификация дисперсных систем
Существует несколько классификаций дисперсных систем:
- по размеру частиц (по степени дисперсности, раздробленности);
- по агрегатному состоянию дисперсной фазы и дисперсионной среды;
- по наличию или отсутствию взаимодействия между частицами дисперсной фазы;
- по интенсивности взаимодействия частиц дисперсной фазы с молекулами дисперсионной среды;
- по термодинамической и кинетической устойчивости дисперсных систем и т. д.
Классификация дисперсных систем по размеру частиц
Количественной характеристикой дисперсности вещества является степень дисперсности (D). Численно она равна числу частиц, которые можно плотно уложить в ряд (или стопку) на протяжении одного сантиметра.
Условно принятые границы размеров частиц с различной степенью раздробленности:
1) грубодисперсные (суспензии, эмульсии, порошки) — размер частиц больше 100 нм;
2) высокодисперсные (коллоидные растворы) — размер частиц от 1 до
100 нм;
3) истинные растворы (водные растворы кислот, щелочей, солей, одноатомных и многоатомных спиртов) — размер частиц меньше 1 нм.
Если все частицы дисперсной фазы имеют одинаковые размеры, то такие системы называют монодисперсными.
Частицы дисперсной фазы разного размера образуют полидисперсные системы. В реальных дисперсных системах частицы имеют различные размеры.
Классификация дисперсных систем по агрегатному состоянию (табл. 1).
 Таблица 1. Типы дисперсных систем
Таблица 1. Типы дисперсных систем
*Чтобы подчеркнуть, что дисперсионной средой является жидкость, их называют лиозолями (от греч. «лиос» — жидкость). Если дисперсионной средой является вода, такие золи называют гидрозолями. Если органическая жидкость — органозолями.
Классификация дисперсных систем по наличию или отсутствию взаимодействия между частицами дисперсной фазы.
Свободнодисперсные. В этих системах частицы дисперсной фазы не имеют контактов, участвуют в беспорядочном тепловом движении, свободно перемещаются под действием силы тяжести. Такие системы текучи.
К свободнодисперсным системам относятся:
— аэрозоли;
— лизоли;
— разбавленные суспензии и эмульсии.
Связнодисперсные. Возникают при контакте частиц дисперсной фазы, которые приводят к образованию структуры в виде каркаса или скелета. Эта структура ограничивает текучесть дисперсионной среды и придаёт ей способность сохранять форму. Именно поэтому связнодисперсные системы твёрдообразные. Подобные структурированные коллоидные системы называются гелями.
К связнодисперсным системам относятся:
- порошки;
- концентрированные эмульсии и суспензии (пасты);
- пены;
- почва, т. к. она образовалась в результате контакта и уплотнения дисперсных частиц почвенных минералов и гумусовых (органических) веществ.
Сплошную массу вещества могут пронизывать поры и капилляры, образующие капиллярнодисперсные системы. К ним относятся: древесина, разнообразные мембраны и диафрагмы, кожа, бумага, картон, ткань.
Пример 2
Установите соответствие между дисперсной системой и её классификацией по агрегатному состоянию. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
| ДИСПЕРСНАЯ СИСТЕМА | КЛАССИФИКАЦИЯ |
| A) туман | 1) твёрдое в твёрдом |
| Б) сплавы | 2) жидкость в жидкости |
| B) эмульсии | 3) жидкость в газе |
| Г) золи | 4) газ в жидкости |
| 5) твёрдое в жидкости | |
| 6) твёрдое в газе |
Решение
Рассмотрим каждую из представленных систем.
1. Туман — это газовая смесь, внутри которой распределены капельки жидкости. Это подходит под определение дисперсной системы «жидкость в газе».
2. Сплавы — смесь из двух металлов, где один металл распределён внутри другого. Это подходит под определение дисперсной системы «твёрдое в твёрдом».
3. Эмульсии — смесь двух жидкостей, в которой мельчайшие частички одной из них распределены внутри другой. Это подходит под определение дисперсной системы «жидкость в жидкости».
4. Золи — сложные смеси, в основе которых лежит жидкая или газообразная фаза, внутри которой распределены пузырьки другой жидкости или газа. Это подходит под определение дисперсной системы «твёрдое в жидкости».
Ответ: 3, 1, 2, 5.
Упражнение 1
1. Плазма крови представляет собой дисперсную систему:
1) жидкость в твердом веществе,
2) твёрдое вещество в жидкости,
3) газ в жидкости,
4) жидкость в жидкости.
2. Природной эмульсией является:
1) хрящи,
2) облака,
3) воздух,
4) нефть.
Свойства коллоидных систем
Оптические свойства коллоидных систем
 Рис. 2. Явление Тиндаля
Рис. 2. Явление Тиндаля
Коллоидные системы обладают способностью светорассеивания.
Взаимодействие света с веществом зависит от соотношения длины волны света и размеров частиц, на которые падает световой поток. Если размеры частицы больше длины волны, происходит отражение или преломление света. Если размеры частицы меньше половины длины волны падающего света, происходит рассеивание света в результате дифракции.
Размеры коллоидной частицы меньше половины длины волны падающего света. Поэтому коллоидные частицы не отражают, а рассеивают свет (явление опалесценции).
Светорассеивание характерно и для истинных растворов. Но только в коллоидных системах можно наблюдать явление Тиндаля: при боковом рассмотрении коллоидного раствора, через который проходит световой луч, внутри коллоидной системы наблюдается светящийся конус.
Молекулярно-кинетические свойства коллоидных систем
Молекулярно-кинетические свойства — это те свойства, которые связаны хаотическим тепловым движением частиц, образующих те или иные системы.
К молекулярно-кинетические свойствам дисперсных систем относят: броуновское движение, диффузию, седиментацию.
Броуновское движение — беспорядочное, хаотичное (подобно рою комаров) движение частиц. Это явление получило название по имени Р. Броуна, который в 1827 г. обнаружил под микроскопом непрерывные колебательные движения пыльцы растений в её взвеси с водой.
 Рис. 3. Седиментация
Рис. 3. Седиментация
Седиментация — осаждение частиц дисперсной фазы под действием силы тяжести.
Седиментируют только достаточно крупные частицы. Например, частицы кварца размером 5 • 103 нм оседают в воде за 3 ч на 3 см. Седиментации частиц размером 103 нм и менее препятствует броуновское движение.
Синерезис представляет собой самопроизвольное уменьшение объёма студней или гелей, которое сопровождается отделением жидкости — дисперсионной среды.
 Рис. 4. Синерезис геля
Рис. 4. Синерезис геля
Коагуля́ция представляет собой слипание частиц коллоидной системы при их столкновениях в процессе теплового (броуновского) движения, перемешивания или направленного перемещения во внешнем силовом поле. В результате коагуляции происходит образование более крупных частиц — агрегатов, которые являются вторичными и состоят из скопления более мелких, то есть первичных частиц.
Пример 3
Установите соответствие между явлением и его описанием. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
| ЯВЛЕНИЕ | ОПИСАНИЕ ЯВЛЕНИЯ |
| А) коагуляция | 1) образование конуса «светящейся дорожки» при пропускании через коллоидный раствор луча света |
| Б) синерезис | 2) слипание коллоидных частиц и выпадение их в осадок |
| В) эффект Тиндаля | 3) самопроизвольное уменьшение объёма геля, сопровождающееся отделением жидкости |
Решение
Рассмотрим представленные явления.
1. Коагуляция представляет собой сгущение частиц, то есть слипание коллоидных частиц с их последующим выпадением в осадок.
2. Синерезис представляет собой уменьшение объёма, например геля, и выделение жидкости, которая является дисперсной средой.
3. Эффект Тиндаля — при прохождении света через неоднородную среду происходит его конусообразно рассеивание.
Ответ: 2, 3, 1.
Упражнение 2
1. Наименьшие частицы дисперсной фазы:
1) в истинных растворах,
2) в коллоидных растворах,
3) во взвесях,
4) в механических смесях.
2. Свёртывание крови — это явление
1) коагуляции, 2) денатурации,
3) осаждения, 4) синерезиса.
Контрольные вопросы
- Что такое дисперсные системы? Чем они отличаются от других смесей и от истинных растворов?
- Какие типы дисперсных систем выделяют по агрегатному состоянию и по дисперсной фазе? Приведите примеры природных и бытовых дисперсных систем каждого типа.
- Какой процесс называется коагуляцией? Какими факторами она может быть спровоцирована?
- Какой процесс называется синерезисом? Какое значение имеет синерезис в пищевой и медицинской промышленности?
Ответы
Упражнение 1
1) 4
2) 4
Упражнение 2
1) 1
2) 1, 4



