- Понятие амфотерности
- Характеристика амфотерных соединений
- Химические свойства неорганических амфотерных соединений
- Химические свойства органических амфотерных соединений
- иметь представление об амфотерности
- уметь составлять реакции с участием неорганических амфотерных соединений
- уметь составлять реакции с участием органических амфотерных соединений
Химия — это всегда единство противоположностей. Вы уже давно знакомы с такими соединениями, как кислоты и основания (щёлочи). Знаете их характеристики, физические и химические свойства. Также существуют амфотерные соединения. В чём заключается их особенность? В двойственности поведения данных веществ в ходе химической реакции. Так, в зависимости от условий среды они могут реагировать как кислоты, так и как основания.
Амфотерность как понятие в качестве характеристики двойственного поведения вещества было введено в 1814 году Ж. Гей-Люссаком и Л. Тенаром.
Типичные представители неорганических амфотерных соединений — оксиды и гидроксиды, а в органической химии типичные амфотерные соединения — аминокислоты.

Характеристика амфотерных соединений
Оксиды металлов, в которых металл проявляет степень окисления +3 или +4, как правило, относятся к амфотерным.
Среди первых можно назвать оксид и диоксид олова, бериллия, марганца, цинка, железа (ІІІ). Амфотерные гидроксиды представлены такими веществами: гидроксид бериллия, алюминия, железа (ІІІ), метагидроксид железа, алюминия, дигидроксид-оксид титана. Самыми распространёнными и часто используемыми из перечисленных выше соединений являются оксид железа и алюминия, а также гидроксиды этих металлов.
Способность неорганического химического вещества проявлять как кислотные, так и основные свойства, в зависимости от условий реакции, называется амфотерностью.
Амфотерные гидроксиды представляют собой твёрдые кристаллические вещества, практически нерастворимые в воде. Так, например, гидроксид хрома (III) имеет серо-зелёный цвет, а остальные амфотерные гидроксиды по большей части имеют белый цвет.
Химические свойства амфотерных неорганических соединений
Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водорода и проявлять кислотные свойства, так и их акцепторами, а значит проявлять основные свойства.
Взаимодействие с кислотами
Амфотерные соединения взаимодействуют с сильными кислотами, где в реакциях проявляют основные свойства.
Пример 1
Написать реакцию между оксидом алюминия и соляной кислотой.
Решение
Оксид алюминия является одним из ярких представителей амфотерных соединений.
1. Запишем реакцию между хлороводородной кислотой и оксидом алюминия. Уравняем и отметим растворимость:
.
Н P Р Н
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Аналогично в реакцию вступают амфотерные гидроксиды, которые в результате реакции с кислотами также проявляют основные свойства и образуют соль и воду.
При этом нерастворимые амфотерные основания разлагаются при нагревании на оксид металла (в той же степени окисления) и воду:
.
Взаимодействие с щелочами
Амфотерные соединения из оснований реагируют только с растворимыми — щелочами. Например, рассмотрим гидроксид цинка. В привычном виде гидроксид цинка — основание. А раз это основание, то оно будет взаимодействовать с кислотами по обменному механизму:
.
Если гидроксид цинка амфотерен и проявляет кислотные свойства, то как можно переписать его формулу, чтобы он выглядел, как привычная для нас кислота? И какой заряд будет иметь при этом кислотный остаток? Записать формулу гидроксида цинка в кислотной форме достаточно просто. Необходимо поставить на первое место атомы водорода, как в формулах типичных неорганических кислот. В результате получается — цинковая кислота. Тогда будет иметь заряд 2- и будет выступать кислотным остатком с названием «цинкат». А раз это кислота, значит будет реагировать с щелочами.
Пример 2
Написать реакцию между гидроксидом цинка и твёрдым гидроксидом натрия.
Решение
Гидроксид натрия является одним из ярких представителей амфотерных соединений.
1. Запишем реакцию между гидроксидом цинка и гидроксидом натрия (расплавом). Уравняем и отметим растворимость:
.
Н P Р Н
При взаимодействии гидроксида цинка с гидроксидом натрия образуются диоксоцинкат натрия и вода.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Аналогично в реакцию вступают амфотерные оксиды, которые в результате сплавления с твёрдыми растворимыми основаниями (щелочами) также проявляют
кислотные свойства и образуют соль и воду:
.
Также амфотерные соединения способны образовывать комплексные соли в
реакциях с растворами щелочей. Например, при взаимодействии гидроксида
железа (III) с раствором гидроксида натрия продуктом реакции является гексагидроксоферрат натрия — Na3[Fe(OH)6], где 6 — координационное число,
которое находится по формуле: n • 2 (n — валентность амфотерного металла).
Комплексные соли образуются как в результате реакции с оксидами, так и
гидроксидами амфотерных металлов:
,
.
Упражнение 1
Допишите до конца уравнения реакций.
1)
2)
Химические свойства амфотерных органических соединений
В органической химии типичные амфотерные соединения — аминокислоты, общая формула которых (a-аминокислот) такова:
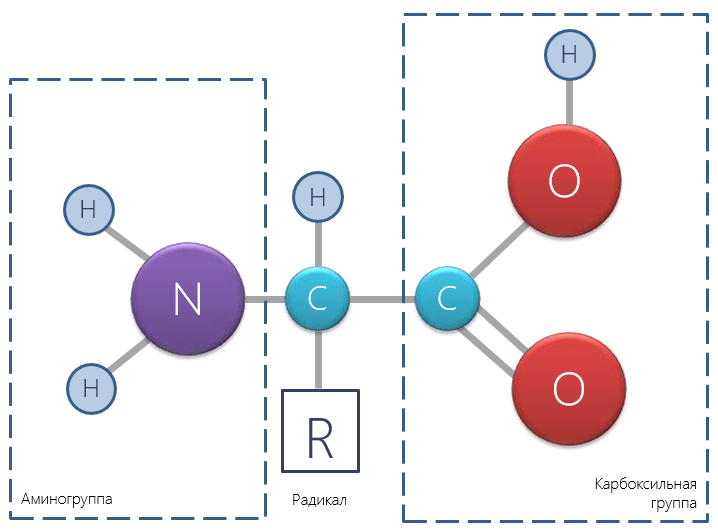
Аминокислоты — это органические вещества, которые обладают одновременно кислотными и основными свойствами.
Основные свойства обусловлены наличием аминогруппы, которая является акцептором протонов а кислотные свойства обеспечивает карбоксильная группа, которая является донором протонов
Реакции по карбоксильной группе
Именно амфотерность аминокислот обусловливает их наиболее характерные свойства.
Кислотные свойства аминокислот проявляются в их способности взаимодействовать, например с основаниями, или вступать в реакцию этерификации с образованием сложных эфиров.
Пример 3
Написать реакцию взаимодействия аминоуксусной кислоты с гидроксидом натрия.
Решение
1. Запишем реакцию между аминоуксусной кислоты с гидроксидом натрия:
.
P P Р Н
При взаимодействии аминоуксусной кислоты с гидроксидом натрия образуются натриевая соль аминоуксусной кислоты и вода.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Также аминокислоты в рамках амфотерности свойств реагируют со спиртами. Так, при взаимодействии аминоуксусной кислоты с метанолом образуются метиловый эфир аминоуксусной кислоты и вода:
.
Реакции по аминогруппе
Основные свойства аминокислот проявляются в их способности взаимодействовать с кислотами, образуя комплексные ионы по донорно-акцепторному механизму.
Пример 4
Написать реакцию между аминоуксусной и соляной кислотами.
Решение
1. Запишем реакцию между аминоуксусной кислотой с соляной кислотой. Уравняем и отметим растворимость:
.
При взаимодействии аминоуксусной кислоты с соляной кислотой образуется хлороводородная соль аминоуксусной кислоты.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
В результате реакции образуется комплексный ион по донорно-акцепторному механизму.
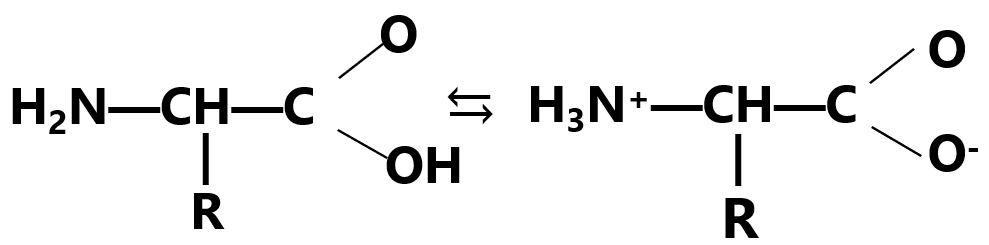
Также амфотерность аминокислот проявляется в их способности в растворе образовывать в результате диссоциации диполярный ион — как бы внутреннюю соль.
Поликонденсация — ступенчатый процесс образования полимеров, который осуществляется за счёт реакции функциональных групп и образования низкомолекулярных побочных продуктов, например: воды, аммония, кислоты.
Аминокислоты могут вступать в реакции друг с другом (реакции поликонденсации), образуя полипептиды и белки.
В результате протекающей реакции наблюдается образование пептидной связи
Пептиды представляют собой органические соединения, которые содержат два или более остатка a-аминокислот, которые связаны пептидной связью.
Упражнение 2
Почему щёлочи никогда нельзя хранить в алюминиевой банке? Запишите уравнение реакции процесса.
Контрольные вопросы
1. C какими веществами взаимодействую
2. В чём отличие амфотерных гидроксидов от щелочей?
3. В чём отличие амфотерных гидроксидов от кислот?
4. Что заключается в понятии «поликонденсация»?
5. Какие вы помните аминокислоты из курса 10 класса?
Ответы
Упражнение 1
1)
2) Al(OH)3 + 2KOH → K3AlO3 + 2H2O
Упражнение 2
Алюминий реагирует со щелочами, поэтому щёлочи нельзя хранить в алюминиевой посуде:
.
- Понятие амфотерности
- Характеристика амфотерных соединений
- Химические свойства неорганических амфотерных соединений
- Химические свойства органических амфотерных соединений
- иметь представление об амфотерности
- уметь составлять реакции с участием неорганических амфотерных соединений
- уметь составлять реакции с участием органических амфотерных соединений
Химия — это всегда единство противоположностей. Вы уже давно знакомы с такими соединениями, как кислоты и основания (щёлочи). Знаете их характеристики, физические и химические свойства. Также существуют амфотерные соединения. В чём заключается их особенность? В двойственности поведения данных веществ в ходе химической реакции. Так, в зависимости от условий среды они могут реагировать как кислоты, так и как основания.
Амфотерность как понятие в качестве характеристики двойственного поведения вещества было введено в 1814 году Ж. Гей-Люссаком и Л. Тенаром.
Типичные представители неорганических амфотерных соединений — оксиды и гидроксиды, а в органической химии типичные амфотерные соединения — аминокислоты.

Характеристика амфотерных соединений
Оксиды металлов, в которых металл проявляет степень окисления +3 или +4, как правило, относятся к амфотерным.
Среди первых можно назвать оксид и диоксид олова, бериллия, марганца, цинка, железа (ІІІ). Амфотерные гидроксиды представлены такими веществами: гидроксид бериллия, алюминия, железа (ІІІ), метагидроксид железа, алюминия, дигидроксид-оксид титана. Самыми распространёнными и часто используемыми из перечисленных выше соединений являются оксид железа и алюминия, а также гидроксиды этих металлов.
Способность неорганического химического вещества проявлять как кислотные, так и основные свойства, в зависимости от условий реакции, называется амфотерностью.
Амфотерные гидроксиды представляют собой твёрдые кристаллические вещества, практически нерастворимые в воде. Так, например, гидроксид хрома (III) имеет серо-зелёный цвет, а остальные амфотерные гидроксиды по большей части имеют белый цвет.
Химические свойства амфотерных неорганических соединений
Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водорода и проявлять кислотные свойства, так и их акцепторами, а значит проявлять основные свойства.
Взаимодействие с кислотами
Амфотерные соединения взаимодействуют с сильными кислотами, где в реакциях проявляют основные свойства.
Пример 1
Написать реакцию между оксидом алюминия и соляной кислотой.
Решение
Оксид алюминия является одним из ярких представителей амфотерных соединений.
1. Запишем реакцию между хлороводородной кислотой и оксидом алюминия. Уравняем и отметим растворимость:
.
Н P Р Н
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Аналогично в реакцию вступают амфотерные гидроксиды, которые в результате реакции с кислотами также проявляют основные свойства и образуют соль и воду.
При этом нерастворимые амфотерные основания разлагаются при нагревании на оксид металла (в той же степени окисления) и воду:
.
Взаимодействие с щелочами
Амфотерные соединения из оснований реагируют только с растворимыми — щелочами. Например, рассмотрим гидроксид цинка. В привычном виде гидроксид цинка — основание. А раз это основание, то оно будет взаимодействовать с кислотами по обменному механизму:
.
Если гидроксид цинка амфотерен и проявляет кислотные свойства, то как можно переписать его формулу, чтобы он выглядел, как привычная для нас кислота? И какой заряд будет иметь при этом кислотный остаток? Записать формулу гидроксида цинка в кислотной форме достаточно просто. Необходимо поставить на первое место атомы водорода, как в формулах типичных неорганических кислот. В результате получается — цинковая кислота. Тогда будет иметь заряд 2- и будет выступать кислотным остатком с названием «цинкат». А раз это кислота, значит будет реагировать с щелочами.
Пример 2
Написать реакцию между гидроксидом цинка и твёрдым гидроксидом натрия.
Решение
Гидроксид натрия является одним из ярких представителей амфотерных соединений.
1. Запишем реакцию между гидроксидом цинка и гидроксидом натрия (расплавом). Уравняем и отметим растворимость:
.
Н P Р Н
При взаимодействии гидроксида цинка с гидроксидом натрия образуются диоксоцинкат натрия и вода.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Аналогично в реакцию вступают амфотерные оксиды, которые в результате сплавления с твёрдыми растворимыми основаниями (щелочами) также проявляют
кислотные свойства и образуют соль и воду:
.
Также амфотерные соединения способны образовывать комплексные соли в
реакциях с растворами щелочей. Например, при взаимодействии гидроксида
железа (III) с раствором гидроксида натрия продуктом реакции является гексагидроксоферрат натрия — Na3[Fe(OH)6], где 6 — координационное число,
которое находится по формуле: n • 2 (n — валентность амфотерного металла).
Комплексные соли образуются как в результате реакции с оксидами, так и
гидроксидами амфотерных металлов:
,
.
Упражнение 1
Допишите до конца уравнения реакций.
1)
2)
Химические свойства амфотерных органических соединений
В органической химии типичные амфотерные соединения — аминокислоты, общая формула которых (a-аминокислот) такова:

Аминокислоты — это органические вещества, которые обладают одновременно кислотными и основными свойствами.
Основные свойства обусловлены наличием аминогруппы, которая является акцептором протонов а кислотные свойства обеспечивает карбоксильная группа, которая является донором протонов
Реакции по карбоксильной группе
Именно амфотерность аминокислот обусловливает их наиболее характерные свойства.
Кислотные свойства аминокислот проявляются в их способности взаимодействовать, например с основаниями, или вступать в реакцию этерификации с образованием сложных эфиров.
Пример 3
Написать реакцию взаимодействия аминоуксусной кислоты с гидроксидом натрия.
Решение
1. Запишем реакцию между аминоуксусной кислоты с гидроксидом натрия:
.
P P Р Н
При взаимодействии аминоуксусной кислоты с гидроксидом натрия образуются натриевая соль аминоуксусной кислоты и вода.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Также аминокислоты в рамках амфотерности свойств реагируют со спиртами. Так, при взаимодействии аминоуксусной кислоты с метанолом образуются метиловый эфир аминоуксусной кислоты и вода:
.
Реакции по аминогруппе
Основные свойства аминокислот проявляются в их способности взаимодействовать с кислотами, образуя комплексные ионы по донорно-акцепторному механизму.
Пример 4
Написать реакцию между аминоуксусной и соляной кислотами.
Решение
1. Запишем реакцию между аминоуксусной кислотой с соляной кислотой. Уравняем и отметим растворимость:
.
При взаимодействии аминоуксусной кислоты с соляной кислотой образуется хлороводородная соль аминоуксусной кислоты.
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
В результате реакции образуется комплексный ион по донорно-акцепторному механизму.
Также амфотерность аминокислот проявляется в их способности в растворе образовывать в результате диссоциации диполярный ион — как бы внутреннюю соль.

Поликонденсация — ступенчатый процесс образования полимеров, который осуществляется за счёт реакции функциональных групп и образования низкомолекулярных побочных продуктов, например: воды, аммония, кислоты.
Аминокислоты могут вступать в реакции друг с другом (реакции поликонденсации), образуя полипептиды и белки.
В результате протекающей реакции наблюдается образование пептидной связи
Пептиды представляют собой органические соединения, которые содержат два или более остатка a-аминокислот, которые связаны пептидной связью.
Упражнение 2
Почему щёлочи никогда нельзя хранить в алюминиевой банке? Запишите уравнение реакции процесса.
Контрольные вопросы
1. C какими веществами взаимодействую
2. В чём отличие амфотерных гидроксидов от щелочей?
3. В чём отличие амфотерных гидроксидов от кислот?
4. Что заключается в понятии «поликонденсация»?
5. Какие вы помните аминокислоты из курса 10 класса?
Ответы
Упражнение 1
1)
2) Al(OH)3 + 2KOH → K3AlO3 + 2H2O
Упражнение 2
Алюминий реагирует со щелочами, поэтому щёлочи нельзя хранить в алюминиевой посуде:
.



