- Физические свойства оснований
- Химические свойства оснований
- Взаимодействие оснований с кислотами
- Взаимодействие оснований с растворами солей
- Применение кислот
- понимать, чем обусловлены физические и химические свойства оснований
- знать особенности химических реакций оснований
- уметь составлять реакции с основаниями
- знать области применения растворимых оснований
Понятие основания сформировалось в XVII веке и было впервые введено в химию французским химиком Гийомом Франсуа Руэлем в 1754 году. Он отметил, что кислоты, известные в те времена как летучие жидкости (к примеру, уксусная или соляная кислоты), превращаются в кристаллические соли только в сочетании с конкретными веществами. Руэль предположил, что такие вещества служат «основаниями» для образования солей в твёрдой форме.
Единая теория кислот и оснований была впервые представлена шведским физикохимиком С. Аррениусом в 1887 году. В рамках своей теории Аррениус определял кислоту как вещество, при диссоциации которого образуются протоны а основание — как вещество, дающее при диссоциации гидроксид-ионы Теория Аррениуса в тоже время имела свои недостатки, к примеру, она не учитывала влияние растворителя на кислотно-основное равновесие и, кроме этого, была неприменима к неводным растворам.
С 1923 года основание стали определять в рамках теорий Брёнстеда — Лоури и Льюиса, которые широко применяются и сегодня.

Физические свойства оснований
При взаимодействии активных металлов и их оксидов с водой образуются основания.
Сложные вещества, в состав которых входят атомы металлов, соединённые с одной или нескольким группами атомов OH, называются основаниями.
Существует много оснований, которые состоят из атома какого-либо металла и присоединённых к нему гидрокси-групп. Гидрокси-группы одновалентны, поэтому формулу основания легко составить по валентности металла. К химическому символу металла надо приписать столько гидрокси-групп, какова валентность металла. Большинство оснований — ионные соединения.
Большая часть оснований — твёрдые вещества, которые характеризуются различной растворимостью в воде:
- щелочи — растворимые в воде основания — чаще всего твёрдые вещества белого цвета;
- водные растворы щелочей изменяют окраску индикаторов: лакмус — синий, фенолфталеин — малиновый, метиловый оранжевый–жёлтый;
- нерастворимые в воде основания могут иметь различную окраску, например, гидроксид железа (III) — твёрдое вещество бурого цвета, гидроксид алюминия — твёрдое вещество белого цвета, а гидроксид меди (II) — твёрдое вещество голубого цвета.
Электролиты, диссоциирующие на катион металла и анионы, являются основаниями.
Химические свойства оснований
Основания являются веществами, которые могут присоединять к себе протоны. Таким образом, они являются акцепторами протонов.
Взаимодействие кислот с основаниями
Взаимодействие кислот со щелочами
Щёлочи — гидроксиды щелочных и щелочно-земельных металлов и аммония, которые являются хорошо растворимыми основаниями и при диссоциации образуют анионы и катион металла.
Реакция нейтрализации — реакция между кислотами и щелочами.
Пример 1
Написать реакцию между азотной кислотой и гидроксидом натрия.
Решение
1. Запишем реакцию между азотной кислотой и гидроксидом натрия. Уравняем и отметим растворимость:
.
Р P Р Н
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Взаимодействие кислот c нерастворимыми основаниями
Основания взаимодействуют с кислотами, вступая с ними в реакцию обмена, в результате также выделяется вода.
Пример 2
Написать реакцию между азотной кислотой и гидроксидом меди (II).
Решение
1. Запишем реакцию между азотной кислотой и гидроксидом меди. Уравняем и отметим растворимость:
.
Р P Р Н
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Взаимодействие кислот c органическими основаниями
Органические основания взаимодействуют с кислотами, вступая с ними в реакцию, в результате образуются соли по донорно-акцепторному механизму.
Пример 3
Написать реакцию между хлороводородной кислотой и метиламином.
Решение
1. Запишем реакцию между соляной кислотой и метиламином. Уравняем и отметим растворимость:
.
Р Н Р
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Взаимодействие щелочей с кислотными оксидами
Щелочи взаимодействуют с кислотными оксидами с образованием соли и воды.
Так, например реакция взаимодействия гидроксида кальция с углекислым газом является качественной реакцией на углекислый газ:
.
Качественная реакция — реакция, которая позволяет обнаружить тот или иной ион, вещество или функциональную группу.
Взаимодействие щелочей с кислотными оксидами
Растворы щелочей взаимодействуют с растворами солей, если в результате образуется осадок или газ.
Пример 4
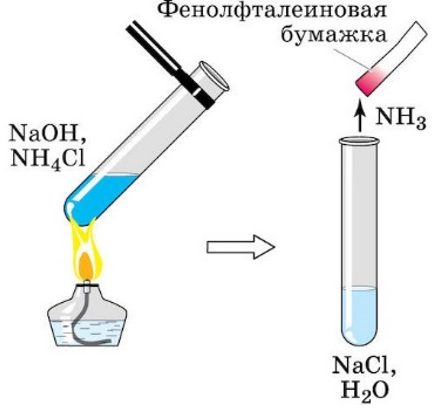
Написать реакцию между хлоридом аммония и гидроксидом натрия.
Решение
1. Запишем реакцию между хлоридом аммония и гидроксидом натрия. Уравняем и отметим растворимость:
.
Р Н Р Н Н
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Применение оснований
Из всех оснований наиболее широкое применение находят щёлочи. Раствор одной из них вы наверняка сможете найти дома. Эту жидкость под названием «Крот» используют в быту для промывания труб, идущих от кухонных раковин. Дело в том, что эти трубы постепенно засоряются остатками жира, которые мешают стоку воды. А щёлочи обладают способностью растворять жиры. Поэтому достаточно в засорённую трубу влить небольшое количество «Крота», через некоторое время проблема будет решена.
В последнее время в быту получили широкое распространение щелочные гели — густые жидкости, содержащие гидроксид натрия. Они предназначены для быстрого удаления остатков пригоревшего жира с поверхности кухонных плит и СВЧ- печей.
Большое количество гидроксида кальция используется в производстве сахара из сахарной свеклы.
Из нерастворимых оснований применение находят гидроксиды алюминия и магния Они входят в состав медицинского препарата «Алмагель», который используют при заболеваниях пищеварительной системы.
Упражнение 1
Какой газ пропускается через известковую воду (насыщенный раствор гидроксида кальция), в результате чего раствор мутнеет, поскольку выпадает осадок белого цвета — образуется нерастворимый карбонат кальция? Запишите уравнение данной химической реакции.
Контрольные вопросы
- Гидроксид железа (III) разлагается в отличие от гидроксида натрия. Верно ли это?
- Почему фенол относят к кислотам, а анилин — к основаниям?
- Для чего используются индикаторы?
- Водные растворы аммиака и аминов имеют щелочную среду и окрашивают раствор фенолфталеина в малиновый цвет. Почему анилин такого действия не оказывает?
Ответы
Упражнение 1
Углекислый газ,
- Физические свойства оснований
- Химические свойства оснований
- Взаимодействие оснований с кислотами
- Взаимодействие оснований с растворами солей
- Применение кислот
- понимать, чем обусловлены физические и химические свойства оснований
- знать особенности химических реакций оснований
- уметь составлять реакции с основаниями
- знать области применения растворимых оснований
Понятие основания сформировалось в XVII веке и было впервые введено в химию французским химиком Гийомом Франсуа Руэлем в 1754 году. Он отметил, что кислоты, известные в те времена как летучие жидкости (к примеру, уксусная или соляная кислоты), превращаются в кристаллические соли только в сочетании с конкретными веществами. Руэль предположил, что такие вещества служат «основаниями» для образования солей в твёрдой форме.
Единая теория кислот и оснований была впервые представлена шведским физикохимиком С. Аррениусом в 1887 году. В рамках своей теории Аррениус определял кислоту как вещество, при диссоциации которого образуются протоны а основание — как вещество, дающее при диссоциации гидроксид-ионы Теория Аррениуса в тоже время имела свои недостатки, к примеру, она не учитывала влияние растворителя на кислотно-основное равновесие и, кроме этого, была неприменима к неводным растворам.
С 1923 года основание стали определять в рамках теорий Брёнстеда — Лоури и Льюиса, которые широко применяются и сегодня.

Физические свойства оснований
При взаимодействии активных металлов и их оксидов с водой образуются основания.
Сложные вещества, в состав которых входят атомы металлов, соединённые с одной или нескольким группами атомов OH, называются основаниями.
Существует много оснований, которые состоят из атома какого-либо металла и присоединённых к нему гидрокси-групп. Гидрокси-группы одновалентны, поэтому формулу основания легко составить по валентности металла. К химическому символу металла надо приписать столько гидрокси-групп, какова валентность металла. Большинство оснований — ионные соединения.
Большая часть оснований — твёрдые вещества, которые характеризуются различной растворимостью в воде:
- щелочи — растворимые в воде основания — чаще всего твёрдые вещества белого цвета;
- водные растворы щелочей изменяют окраску индикаторов: лакмус — синий, фенолфталеин — малиновый, метиловый оранжевый–жёлтый;
- нерастворимые в воде основания могут иметь различную окраску, например, гидроксид железа (III) — твёрдое вещество бурого цвета, гидроксид алюминия — твёрдое вещество белого цвета, а гидроксид меди (II) — твёрдое вещество голубого цвета.
Электролиты, диссоциирующие на катион металла и анионы, являются основаниями.
Химические свойства оснований
Основания являются веществами, которые могут присоединять к себе протоны. Таким образом, они являются акцепторами протонов.
Взаимодействие кислот с основаниями
Взаимодействие кислот со щелочами
Щёлочи — гидроксиды щелочных и щелочно-земельных металлов и аммония, которые являются хорошо растворимыми основаниями и при диссоциации образуют анионы и катион металла.
Реакция нейтрализации — реакция между кислотами и щелочами.
Пример 1
Написать реакцию между азотной кислотой и гидроксидом натрия.
Решение
1. Запишем реакцию между азотной кислотой и гидроксидом натрия. Уравняем и отметим растворимость:
.
Р P Р Н
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Взаимодействие кислот c нерастворимыми основаниями
Основания взаимодействуют с кислотами, вступая с ними в реакцию обмена, в результате также выделяется вода.
Пример 2
Написать реакцию между азотной кислотой и гидроксидом меди (II).
Решение
1. Запишем реакцию между азотной кислотой и гидроксидом меди. Уравняем и отметим растворимость:
.
Р P Р Н
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Взаимодействие кислот c органическими основаниями
Органические основания взаимодействуют с кислотами, вступая с ними в реакцию, в результате образуются соли по донорно-акцепторному механизму.
Пример 3
Написать реакцию между хлороводородной кислотой и метиламином.
Решение
1. Запишем реакцию между соляной кислотой и метиламином. Уравняем и отметим растворимость:
.
Р Н Р
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.
Взаимодействие щелочей с кислотными оксидами
Щелочи взаимодействуют с кислотными оксидами с образованием соли и воды.
Так, например реакция взаимодействия гидроксида кальция с углекислым газом является качественной реакцией на углекислый газ:
.
Качественная реакция — реакция, которая позволяет обнаружить тот или иной ион, вещество или функциональную группу.
Взаимодействие щелочей с кислотными оксидами
Растворы щелочей взаимодействуют с растворами солей, если в результате образуется осадок или газ.
Пример 4
Написать реакцию между хлоридом аммония и гидроксидом натрия.
Решение
1. Запишем реакцию между хлоридом аммония и гидроксидом натрия. Уравняем и отметим растворимость:
.
Р Н Р Н Н
2. Запишем реакцию в полном ионном виде:
.
3. Запишем сокращённое ионное уравнение:
.

Применение оснований
Из всех оснований наиболее широкое применение находят щёлочи. Раствор одной из них вы наверняка сможете найти дома. Эту жидкость под названием «Крот» используют в быту для промывания труб, идущих от кухонных раковин. Дело в том, что эти трубы постепенно засоряются остатками жира, которые мешают стоку воды. А щёлочи обладают способностью растворять жиры. Поэтому достаточно в засорённую трубу влить небольшое количество «Крота», через некоторое время проблема будет решена.
В последнее время в быту получили широкое распространение щелочные гели — густые жидкости, содержащие гидроксид натрия. Они предназначены для быстрого удаления остатков пригоревшего жира с поверхности кухонных плит и СВЧ- печей.
Большое количество гидроксида кальция используется в производстве сахара из сахарной свеклы.
Из нерастворимых оснований применение находят гидроксиды алюминия и магния Они входят в состав медицинского препарата «Алмагель», который используют при заболеваниях пищеварительной системы.

Упражнение 1
Какой газ пропускается через известковую воду (насыщенный раствор гидроксида кальция), в результате чего раствор мутнеет, поскольку выпадает осадок белого цвета — образуется нерастворимый карбонат кальция? Запишите уравнение данной химической реакции.
Контрольные вопросы
- Гидроксид железа (III) разлагается в отличие от гидроксида натрия. Верно ли это?
- Почему фенол относят к кислотам, а анилин — к основаниям?
- Для чего используются индикаторы?
- Водные растворы аммиака и аминов имеют щелочную среду и окрашивают раствор фенолфталеина в малиновый цвет. Почему анилин такого действия не оказывает?
Ответы
Упражнение 1
Углекислый газ,

