- Классификация химических реакций по числу и составу реагентов и образующихся веществ
- Классификация химических реакций по тепловому эффекту
- Классификация химических реакций по агрегатному состоянию реагирующих веществ
- Классификация химических реакций по обратимости
- Классификация химических реакций по использованию катализатора
- Классификация химических реакций по изменению степеней окисления элементов
- обобщить представление о химической реакции
- рассмотреть некоторые из многочисленных классификаций химических реакций по различным признакам
- Что такое химическая реакция?
- Чем химическая реакция отличается от химического явления?
- Какие типы химических реакций вы знаете?
Как мы уже знаем, существует огромное количество различных химических веществ. Химические реакции также очень разнообразны. В связи с этим возникает необходимость в их классификации.
Критериев классификации химических реакций очень много. Мы рассмотрим некоторые из них. И начнём с классификации химических реакций по числу и составу реагентов и образующихся веществ.
Классификация химических реакций по числу и составу реагентов и образующихся веществ
Чтобы определить тип реакции по данному критерию, нужно обратиться к уравнению реакции.
1. Реакции соединения
Реакциями соединения называют реакции, при которых из двух или более простых или сложных веществ образуется одно сложное.
Например, реакция образования газа аммиака — реакция соединения:
.
В реакцию соединения могут вступать сложное вещество и простое:
.
Или сложные вещества:
.
Самый главный критерий реакций соединения — образование одного продукта в ходе реакции.
2. Реакции разложения
Реакции разложения — реакции, при которых из одного сложного вещества образуются несколько простых или сложных веществ.
Реакции разложения противоположны реакциям соединения.
Например, разложение гидрокарбоната натрия при нагревании:
.
Нерастворимые гидроксиды можно разложить на оксид и воду при нагревании:
.
3. Реакции замещения
Реакции замещения — реакции, при которых из одного простого вещества и одного сложного вещества образуется новое простое вещество и новое сложное.
К реакциям замещения относятся реакции взаимодействия кислот и металлов, например:
.
Кальций — простое вещество, серная кислота — сложное. В ходе реакции кальций вытесняет водород из серной кислоты и образуется новое простое вещество — водород и новое сложное вещество — сульфат кальция.
Также более активные металлы могут вытеснять менее активные из состава их солей:
.
4. Реакции обмена
Реакции обмена — реакции, при которых из двух сложных веществ образуются два новых сложных.
В таких реакция исходные вещества обмениваются своими составными частями.
Среди реакций обмена очень много качественных реакций.
Качественная реакция — реакция, с помощью которой определяют наличие того или иного вещества.
Например, реакция взаимодействия нитрата серебра и хлорида натрия:
.
В ходе реакции наблюдается выпадение белого осадка — хлорида серебра.

Известной и яркой реакцией является реакция взаимодействия сульфата меди (II) и гидроксида натрия:
.
В ходе реакции выпадает осадок голубого цвета — гидроксид меди (II).
К особому типу реакций обмена относят реакции нейтрализации — реакции между кислотами и щелочами с образованием соли и воды.
Например, при взаимодействии соляной кислоты и гидроксида бария образуется соль — хлорид бария и вода:
.
Пример 1
Определите, к какому типу относится взаимодействие между соляной кислотой и барием.
Решение
1. В начале запишем уравнение этой реакции.
2. Барий и водород — простые вещества, соляная кислота и хлорид цинка — сложные. Следовательно, в данной реакции взаимодействуют простое вещество со сложным и образуются новое простое и новое сложное вещество, что соответствует реакции замещения.
Ответ: это реакция замещения.
Упражнение 1
1. Приведите пример для каждого из четырёх типов реакций.
2. К какому типу может относиться реакция, в которой простое вещество взаимодействует со сложным?
3. К какому типу может относиться реакция, в которой образуются два сложных вещества?
Классификация химических реакций по тепловому эффекту
В ходе химических реакций происходит поглощение или выделение теплоты. По данному критерию химические реакции делят на два типа:
- эндотермические реакции — реакции, протекающие с поглощением теплоты;
- экзотермические реакции — реакции, протекающие с выделением теплоты.
Количество теплоты, выделяющееся или поглощающееся в результате протекания химической реакции, называют её тепловым эффектом.
Тепловой эффект принято обозначать буквой Q и измеряется он в килоджоулях (кДж), если говорить о реакции в целом или в кДж/моль, если говорить о каком-либо веществе в реакции.
Для эндотермических реакций тепловой эффект будет принимать отрицательное значение, а для экзотермических — положительное.
Экзотермические — реакции горения и большинство реакций соединения, а эндотермические — реакции разложения.
В уравнениях реакций можно указывать тепловой эффект, тогда такое уравнение называется термохимическим. Например:
.
По термохимическому уравнению можно рассчитать, какое количество теплоты выделится или поглотится в ходе химической реакции.
Классификация химических реакций по агрегатному состоянию реагирующих веществ
Здесь нам нужно познакомиться с понятием фаза.
Фазой называется часть системы, имеющая в любой точке одинаковые состав и свойства и отделённая от других фаз границей раздела.
Фаза может быть газообразной, жидкой или твёрдой.
В зависимости от агрегатного состояния реагентов химические реакции делятся на:
- гомогенные реакции — реагенты находятся в одной фазе и между ними нет поверхности раздела;
- гетерогенные реакции — реакции, протекающие между веществами, которые находятся в разных фазах.
Упражнение 2
- Протекает ли химическая реакция при растворении соды в уксусной кислоте? Если да, то по какому признаку можно определить протекание реакции?
- К какому типу по признаку агрегатного состояния реагентов будет относиться данная реакция?
Классификация химических реакций по обратимости
По данному критерию химические реакции делятся на необратимые и обратимые.
Необратимые реакции — реакции, протекающие только в одном направлении.
Например, при взаимодействии железа и серы происходит образование сульфида железа (II):
.
Повернуть данную реакции вспять не получится, она необратима.
Обратимые реакции — реакции, которые в одних и тех же условиях протекают в двух взаимно противоположных направлениях.
Например, при взаимодействии азота и водорода образуется аммиак:
.
Такая реакция может протекать и в обратном направлении, то есть аммиак будет разлагаться на азот и водород:
.
Чтобы показать обратимость, используют специальный знак — две противоположно направленные стрелки:
.
Классификация химических реакций по использованию катализатора
По этому критерию химические реакции также подразделяются на две группы: каталитические и некаталитические.
Например, чтобы заставить натрий реагировать с водой, не требуется много усилий. Реакция протекает легко и очень быстро:
.
А вот чтобы, например, разложить пероксид водорода, потребуется катализатор MnO2:
.
В нашем организме также протекает множество каталитических реакции с участием биологических катализаторов — ферментов. Реакции протекающие с разной скоростью изучает раздел химии “химическая кинетика”.
Классификация химических реакций по изменению степеней окисления элементов
Реакции, в ходе которых происходит изменение степеней окисления элементов, образующих реагирующие вещества, называют окислительно-восстановительными реакциями (ОВР).
Процессы в ОВР происходят за счёт передачи электронов. Вещество, отдающее электроны, называется восстановителем (процесс окисления). Вещество, принимающее электроны, называется окислителем (процесс восстановления).
Ниже показана схема протекания окислительно-восстановительной реакции при взаимодействии хлорида меди (II) и алюминия:
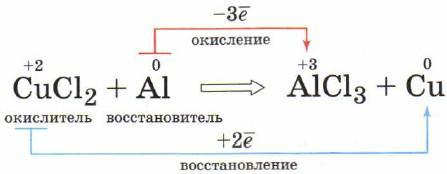
Мы рассмотрели лишь некоторые критерии, по которым можно классифицировать различные химические реакции. Теперь, основываясь на данных признаках, вы сможете с лёгкостью дать характеристику множеству химических реакций.
Контрольные вопросы
- На какие типы делят химические реакции по числу и составу реагентов? Приведите примеры уравнений реакций для каждого типа.
- Что такое тепловой эффект реакции и на какие типы делят химические реакции по тепловому эффекту?
- Что такое гетерогенная и гомогенная реакция?
- По известным вам критериям дайте характеристику реакции, протекающей по схеме:
.
Упражнение 1
2. Соединение и замещение.
3. Разложение и обмен.
Упражнение 2
1. Да, обмен.
2. Гетерогенная.

