- Классификация химических реакций
- Электролиты и неэлектролиты. Электролитическая диссоциация
- Реакции ионного обмена
- Окислительно-восстановительные реакции
- дать классификацию химических реакций по различным признакам
- повторить понятия: электролиты, неэлектролиты, электролитическая диссоциация
- вспомнить признаки реакций ионного обмена
- повторить основные понятия по теме «Окислительно-восстановительные реакции»
- Что такое химическая реакция?
- Какие вещества способны проводить электрический ток?
- Что такое степень окисления элемента?
Классификация химических реакций
В природе мы можем наблюдать два типа явлений: физические и химические. Для химии наибольший интерес представляют химические явления, или химические реакции. Существенным отличием химических явлений от физических является то, что во время химических явлений происходит превращение одних веществ в другие. При физических явлениях состав вещества не изменяется.
Химические реакции всегда сопровождаются какими-либо признаками:
- изменение цвета;
- выпадение или растворение осадка;
- выделение газа;
- изменение окраски индикатора;
- появление запаха и пр.
Конечно, не всегда проявление признака указывает на то, что протекает именно химическая реакция.
Чтобы не потеряться в огромном разнообразии химических реакций, принято их классифицировать по различным признакам.
|
Признак классификации
|
Тип реакций
|
|
По числу и составу реагентов и продуктов реакции
|
|
|
По тепловому эффекту реакции
|
|
|
По изменению степеней окисления элементов
|
|
|
По наличию катализатора
|
|
|
По обратимости
|
|
Упражнение 1
Дано уравнение реакции: . Классифицируйте данную реакцию по известным вам признакам.
Электролиты и неэлектролиты. Электролитическая диссоциация
Вспомним основные понятия.
- Электролиты — вещества, которые в расплавах или растворах проводят электрический ток.
- Неэлектролиты — вещества, которые в расплавах или растворах не проводят электрический ток.
- Электролитическая диссоциация — процесс распада электролита на ионы в растворе или расплаве.
- Ионы — положительно или отрицательно заряженные частицы.
Положительные ионы называют катионами, например, катион водорода или катионы металлов и пр.
Отрицательные ионы называют анионами, например, гидроксид-анион ОН− или анионы кислотных остатков .
Диссоциация электролитов характеризуется особой величиной — степенью диссоциации α, которая находится по формуле:
,
где nд — количество вещества электролита, распавшегося на ионы; nр — количество растворенного вещества.
Степень диссоциации в растворе зависит от природы электролита и его концентрации (чем больше концентрация, тем меньше степень диссоциации, соответственно, степень диссоциации можно увеличить, разбавив раствор).
По степени электролитической диссоциации электролиты можно разделить на сильные и слабые.
Сильные электролиты в растворе полностью распадаются на ионы (α→1), то есть диссоццируют необратимо. К ним относят:
- все растворимые в воде соли;
- щёлочи;
- многие кислоты, например, .
Слабые электролиты лишь частично распадаются на ионы (α→0). Диссоциируют такие электролиты обратимо.
К слабым электролитам относят:
- многие неорганические кислоты, например: ;
- гидрат аммиака ;
- органические кислоты, например, (уксусная кислота).
Упражнение 2
Запишите уравнения электролитической диссоциации сульфата цинка, фосфата калия и гидрокарбоната натрия.
Упражнение 3
При диссоциации 1 моль какого вещества будет образовываться наибольшее число анионов:
1) 2) 3) 4) .
Реакции ионного обмена
Реакции ионного обмена могут протекать в растворах при соблюдении некоторых условий:
- выпадение осадка;
- выделение газа;
- образование слабого электролите (в частности воды).
Для протекания реакции должно соблюдаться хотя бы одно условие.
В растворе не могут одновременно существовать ионы, которые образуют нерастворимое или малорастворимое вещество, газ или молекулы слабого электролита.
Упражнение 4
Запишите молекулярное, полное ионное и сокращённое ионное уравнения взаимодействия сульфита калия и азотной кислоты.
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции (ОВР) — реакции, в ходе которых происходит изменение степеней окисления химических элементов.
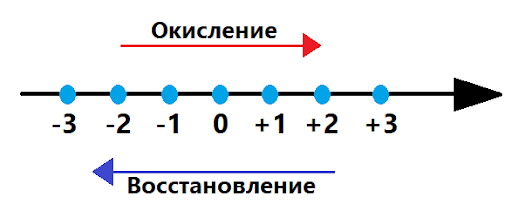
При протекании химических реакций осуществляются два процесса: окисление и восстановление.
Окисление — процесс отдачи электронов. Вещество, которое отдаёт электроны, называется восстановитель.
Восстановление — процесс принятия электронов. Вещество, принимающее электроны, называется окислитель.
Взаимосвязь значений степеней окисления и процессов окисления и восстановления можно увидеть на схеме ниже.
К ОВР относятся все реакции замещения, так как в них всегда участвует простое вещество. Любая реакция с участием простого вещества будет окислительно-восстановительной.
В ОВР число электронов, которые отдал восстановитель, будет равно числу электронов, которые принял окислитель, то есть соблюдается электронный баланс.
Чтобы составить уравнение ОВР методом электронного баланса, нужно выполнить следующие действия:
- Определить степени окисления химических элементов в уравнении реакции и найти те элементы, которые изменили свою с. о.;
- Составить уравнения перехода электронов, схему электронного баланса и определить процессы окисления и восстановления, а также окислитель и восстановитель;
- Составить молекулярное уравнение реакции с учётом коэффициентов, полученных при составлении электронного баланса.
Пример 1
Дана схема реакции: . Уравнять методом электронного баланса.
Решение
1. Определяем степени окисления:
.
Степень окисления изменили и алюминий, и хлор.
2. Составляем уравнения перехода электронов и схему электронного баланса:
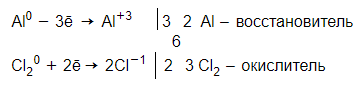
3. Записываем молекулярное уравнение с учетом коэффициентов:
.
Упражнение 5
Уравняйте методом электронного баланса:
.
Контрольные вопросы
- Перечислите типы химических реакций.
- Какой величиной характеризуется электролитическая диссоциация?
- Какие вещества не подвергаются электролитической диссоциации?
- Что такое окисление и восстановление?

