- Понятия электролитов и неэлектролитов
- Механизм электролитической диссоциации
- Степень электролитической диссоциации
- знать понятия: электролиты, неэлектролиты, электролитическая диссоциация
- раскрыть сущность процесса электролитической диссоциации
- уметь применять полученные знания для решения заданий по теме
- Что такое электрический ток?
- Приведите примеры веществ, которые способны проводить электрический ток.
- Что такое ионы?
Вам известно, что растворы некоторых веществ обладают способностью проводить электрический ток. Вспомним, как в химии называются такие вещества.
Электролиты — вещества, растворы и расплавы которых проводят электрический ток. К ним относятся соли, кислоты и щёлочи.
Неэлектролиты — вещества, растворы и расплавы которых не проводят электрический ток. К ним относятся многие органические вещества.
Над выяснением причины электропроводности электролитов работал шведский химик Сванте Аррениус. Он предположил, что при растворении в воде электролиты распадаются (диссоциируют) на ионы.
Из курса физики вы знаете, что электрический ток — это направленное движение заряженных частиц. Ионы как раз и являются такими заряженными частицами, которые способны переносить электрический заряд.
После того как гипотезу Аррениуса подтвердили практически, в науке появилась новая теория — теория электролитической диссоциации.
Электролитическая диссоциация — процесс распада молекул на ионы при растворении или плавлении.
Далее ученики Д. И. Менделеева дополнили теорию некоторыми заключениями:
1. Причиной электролитической диссоциации является взаимодействие электролита с молекулами воды, то есть его гидратация.
2. В растворах ионы находятся не в свободном состоянии, а в гидратированном, то есть связанном с водой.
Пример 1
Определить, к какому типу по степени диссоциации в растворе можно отнести фосфорную кислоту.
Решение
1. В зависимости от степени диссоциации вещества делят не неэлектролиты, сильные и слабые неэлектролиты.
2. Фосфорная кислота слабая, в растворе она диссоциирует на ионы частично, а следовательно, является слабым электролитом.
Ответ: слабый электролит.
Теперь более подробно остановимся на процессах электролитической диссоциации у ионных и молекулярных соединений.
Механизм электролитической диссоциации ионных соединений
Чтобы разобраться с механизмом процесса электролитической диссоциации, нужно для начала вспомнить строение молекулы воды.
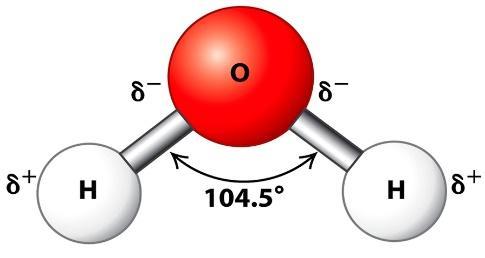 Рисунок 1. Молекула воды — диполь
Рисунок 1. Молекула воды — диполь
Молекула воды представляет собой диполь, то есть имеет два противоположных полюса. Атом водорода менее электроотрицателен, чем атом кислорода, и при возникновении связи между ними электронная пара немного смещается к кислороду. На водороде возникает частичный положительный заряд, а на кислороде — частичный отрицательный. При растворении электролита диполи воды ориентируются вокруг положительных и отрицательных ионов кристаллической решётки электролита противоположными полюсами.
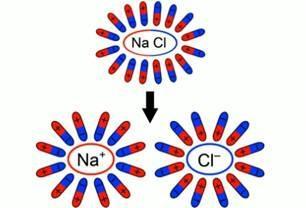 Рисунок 2. Гидратированный ион
Рисунок 2. Гидратированный ион
Когда диполи воды выстраиваются подобным образом, связи в электролите начинают ослабевать, затем кристаллическая решётка разрушается и ионы переходят в раствор. Как мы уже говорили, после процесса гидратации ионы находятся не в свободном состоянии, они связаны с молекулами воды, которые образуют гидратную оболочку иона. Такой ион называется гидратированным.
Упражнение 1
1. Из чего состоит молекула воды?
2. Какой связью она образована?
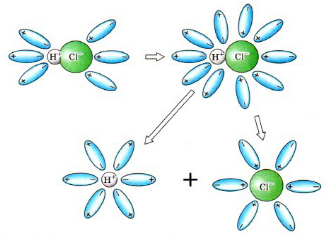 Рисунок 3. Процесс диссоциации
Рисунок 3. Процесс диссоциации
Процесс диссоциации веществ, молекулы которых образованы ковалентной полярной связью, протекает аналогично диссоциации ионных соединений. Ковалентная полярная связь в молекуле превращается в ионную, а затем молекулы электролита под действием воды распадаются на ионы. Для количественной характеристики процесса диссоциации используется особая величина, о которой мы сейчас поговорим.
Степень электролитической диссоциации
Логично предположить, что не все электролиты в равной степени диссоциируют в растворах или расплавах. Способность распадаться на ионы характеризуется особой величиной, которая называется степень диссоциации. Она обозначается буквой α «альфа».
Отношение количества вещества электролита, распавшегося на ионы (nд), к общему количеству растворенного вещества (nр) называют степенью диссоциации:
Определить степень диссоциации вещества можно экспериментально, выражается она в долях или процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 (100 %), то электролит полностью распадается на ионы.
В растворе степень диссоциации будет зависеть от природы электролита и от его концентрации.
Конечно, при разбавлении раствора число молекул воды по сравнению с электролитом увеличивается, поэтому гидратации будет подвергаться большее количество частиц вещества и степень диссоциации будет увеличиваться.
По степени электролитической диссоциации электролиты можно разделить на сильные и слабые.
Сильные электролиты в растворе полностью распадаются на ионы, то есть диссоциируют необратимо. К ним относят:
- все растворимые в воде соли;
- щёлочи;
- многие кислоты, например, .
Слабые электролиты лишь частично распадаются на ионы. Диссоциируют такие электролиты обратимо, т. е. наряду с процессом распада их молекул на ион — диссоциацией — происходит процесс соединения ионов в молекулы — ассоциация.
К слабым электролитам относят:
- многие неорганические кислоты, например: ;
- гидрат аммиака ;
- органические кислоты, например, (уксусная кислота).
В уравнениях диссоциации таких электролитов используют знак обратимости — две противоположно направленные стрелки.
Чтобы записать уравнение электролитической диссоциации для вещества, необходимо воспользоваться таблицей растворимости.
Пример 2
Запишите уравнение диссоциации хлорида кальция и соляной кислоты.
- Хлорид кальция — это растворимая соль, следовательно, полностью распадается на ионы, заряды которых можно найти в таблице растворимости.
- .
- Тогда как сероводородная кислота слабая, а значит, является слабым электролитом и диссоциирует обратимо и ступенчато.
Упражнение 2
1. Что будет происходить со степенью диссоциации при разбавлении раствора?
2. Какие электролиты диссоциируют обратимо?
Контрольные вопросы
1. Почему электролиты способны проводить электрический ток?
2. Что такое степень электролитической диссоциации и на какие группы в связи с этой величиной делятся электролиты?
3. Запишите уравнения электролитической диссоциации для сульфата меди (II), гидроксида бария, фтороводородной кислоты и нитрата натрия. Отметьте сильные и слабые электролиты.

