- План характеристики химического элемента
- Характеристика металла и его соединений
- Характеристика неметалла и его соединений
- рассмотреть план характеристики химического элемента на основании его положения в ПС
- научиться описывать свойства химического элемента и его соединений на основе плана характеристики
- расширить и углубить знания о химических элементах, периодической системе и строении атомов
Элементы и атомы,
В менделеевский взятые круг,
Сделали химию самой богатой
И самой творческой из наук.
Г. Санников
Можно предположить, что химические элементы в периодической системе — это герои, и им, как и любым героям, можно давать определённые характеристики. За основу характеристики химических элементов мы будем брать Периодическую систему химических элементов (ПСХЭ) Д. И. Менделеева.
План характеристики элементов по ПСХЭ
- Порядковый номер элемента, относительная атомная масса (Ar), химический знак.
- Строение атома (заряд ядра (Z), количество протонов, нейтронов, электронов).
- Положение элемента в ПС (период, группа, подгруппа), семейство элемента (s, p, d, f).
- Распределение электронов по энергетическим уровням, электронная формула атома.
- Характер элемента (металл, неметалл).
- Высшая и низшая валентность.
- Сравнение со свойствами соседних элементов (по группе, по периоду).
- Формула высшего оксида, название, его характер.
- Формула гидроксида (основания или кислоты), название, его характер.
- Состав летучего водородного соединения (для неметаллов главных подгрупп), название, характер.
Характеристика металла и его соединений
Охарактеризуем металл калий К
 Рис. 1. Калий в ПСХЭ
Рис. 1. Калий в ПСХЭ
1.Порядковый номер калия, то есть клетка, в которой он стоит, — 19, относительная атомная масса Ar — 39. Химический символ — K.
2. Заряд его ядра равен Z = +19 (заряд ядра атома равен порядковому номеру элемента, числу протонов и числу электронов). Поэтому в атоме 19 электронов, и 19 протонов, а число нейтронов определяется по формуле n = Ar − Z, то есть 39–19 = 20, значит, в атоме 20 нейтронов.
3. Калий расположен в ПС в I группе, главной (A) подгруппе, 4 большом периоде, относится к элементам s-семейства, так как последняя заполненная орбиталь – s.
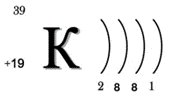 Рис. 2. Электронное строение атома калия
Рис. 2. Электронное строение атома калия
4. Калий находится в 4-ом периоде, значит, у него будет 4 энергетических уровня, на которых будут располагаться все его электроны. На первом уровне 2 электрона (это максимально), на втором — 8, на третьем — 8, на четвёртом, значит, — 1 электрон:
Электронная формула атома калия: 1s22s22p63s23p64s1.
5. Так как калий расположен над диагональю B-At в ПСХЭ, то он является металлом.
6. Сравним свойства элемента калия со свойствами его соседей по группе: металлические свойства калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, так как в группе сверху вниз увеличивается радиус атома и электроны больше отдаляются от ядра, их становится легче отдавать.
7. Сравним свойства элемента калия со свойствами его соседей по периоду: металлические свойства калия выражены сильнее, чем у кальция, так как в периодах слева направо радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается, электроны крепче связаны с ядром, поэтому их становится тяжелее отдавать, чем присоединить.
8. Калий – металл I A группы, его высшая валентность I (определяется номером группы). Металлу соответствует оксид калия – K2O, значит, это основный оксид, и он проявляет все свойства, характерные для этих оксидов: он реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи. Это подтверждается уравнениями реакции:
К2О + 2HCl => 2KCl + H2O
K2O + SO3 => K2SO4
K2O + H2O => 2KOH
9. Гидроксид калия (едкое кали) – это KOH, он является щёлочью – растворимым в воде основанием. Для него будут характерны следующие свойства: реакции с кислотами и кислотными оксидами, реакции с солями. Это подтверждается уравнениями реакции:
КОH + HNO3 => KNO3 + H2O
2KOH + CO2 => K2CO3 + H2O
2KOH + CaCl2 => 2KCl + Ca(OH)2
10. Так как калий – металл, то он не образует летучих водородных соединений.
Пример 1
Охарактеризовать кальций по его положению в ПСХЭ.
Решение
1. Химический знак – Ca, название элемента «Кальций», порядковый номер 20, относительная атомная масса (Аr) = 40.
2. Положение в ПСХЭ: номер группы II, подгруппа главная (А), номер периода 4 большой.
3. Строение атома:
а) заряд ядра: +20;
б) количество электронов и протонов: 20;
в) количество нейтронов: n = 40 − 20 = 20.

4. Количество энергетических уровней = 4, количество электронов на последнем уровне = 2, s-элемент
Электронное строение:
Электронная формула: 1s22s22p63s23p64s2
5. Кальций является металлом.
6. Металлические свойства кальция выражены сильнее, чем у магния, но слабее, чем у стронция.
7. Металлические свойства кальция выражены слабее, чем у калия.
8. Высшая валентность равна II. Металлу соответствует оксид кальция – СаO, значит, это основный оксид, и он проявляет все свойства, характерные для этих оксидов: он реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи. Это подтверждается уравнениями реакции:
СаО + 2HCl => СаCl2 + H2O
СаO + SO3 => СаSO4
СаO + H2O => Са(OH)2
9. Гидроксид кальция Са(OH)2, он является щёлочью – растворимым в воде основанием. Для него будут характерны следующие свойства: реакции с кислотами и кислотными оксидами, реакции с солями. Это подтверждается уравнениями реакции:
Са(OH)2 + H2SO4 => KNO3 + H2O
Са(OH)2 + CO2 => K2CO3 + H2O
Са(OH)2 + CaCl2 => 2KCl + Ca(OH)2
10. Так как калий – металл, то он не образует летучих водородных соединений.
Характеристика неметалла и его соединений
Охарактеризуем неметалл серу (S).
 Рис. 3. Сера в ПСХЭ
Рис. 3. Сера в ПСХЭ
1.Сера находится в клетке номер 16, соответственно её порядковый номер 16, относительная атомная масса Ar — 32. Химический символ — S.
2. Заряд ядра её атома будет Z = +16, а число протонов, как и число электронов равно 16 (равно порядковому номеру). Число нейтронов будет равно 16, так как если мы от относительной атомной массы отнимем число протонов, то будет 16 (n0 = 32 – 16 = 16).
3. Сера расположена в ПС в VI группе, главной (A) подгруппе, 3 малом периоде, относится к элементам p-семейства.
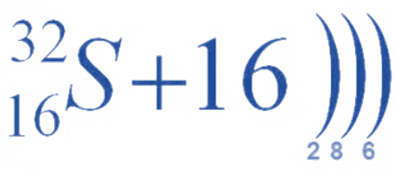 Рис. 4. Электронное строение атома серы
Рис. 4. Электронное строение атома серы
4. Сера находится в третьем периоде, значит, у неё три энергетических уровня: на первом 2 электрона, на втором — 8, а на третьем — 6.
Электронная формула атома серы: 1s22s22p63s23p4.
5. Сера — это неметалл, значит, для нее характерна как высшая, так и низшая валентность. Высшая равна номеру группы – VI, низшая находится по формуле 8-Nгруппы, для серы она равна II (8-6 =2).
6. Сравним свойства элемента серы со свойствами её соседей по группе: неметаллические свойства серы выражены сильнее, чем у селена, но слабее, чем у кислорода, так как радиус у кислорода меньше, чем у серы.
7. По сравнению с соседями по периоду свойства серы выражены сильнее, чем у фосфора, но слабее, чем у хлора.
8. Высший оксид серы (VI) – SO3. Это кислотный оксид, который проявляет свойства, характерные для этих оксидов: он реагирует с основными оксидами, основаниями и водой с образованием соответствующей кислоты. Это подтверждается уравнениями реакции:
SO3 + BaO => BaSO4
SО3 + 2NaOH => Na2SO4 + H2O
SO3 + H2O => H2SO4
9. Высший гидроксид серы – это серная кислота – H2SO4, она проявляет свойства, характерные для всех кислот: реагирует с металлами, основаниями и основными оксидами, с солями. Это подтверждается уравнениями реакции:
H2SО4 + Mg => MgSO4 + H2
H2SO4 + Ca(OH)2 => CaSO4 + 2H2O
H2SO4 + CaO => CaSO4 + H2O
H2SO4 + Na2SiO3 => H2SiO3 + Na2SO4
10. Сера – неметалл, поэтому имеет летучее водородное соединение – H2S – сероводород.
Упражнение 1
Охарактеризуйте химический элемент кремний по тем же характеристикам, что и в примере.
Контрольные вопросы
- Перечислите пункты плана характеристики химического элемента.
- Каким элементам характерно наличие летучих водородных соединений?
1. Химический знак – Si, название элемента «Кремний», порядковый номер 14, относительная атомная масса (Аr) = 28.
2. Положение в ПСХЭ: номер группы IV, подгруппа главная (А), номер периода 3 малый.
3. Строение атома:
а) заряд ядра: +14;
б) количество электронов и протонов: 14;
в) количество нейтронов: n = 28 − 14 = 14.
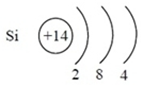
4. Количество энергетических уровней = 3, количество электронов на последнем уровне = 4, р-элемент
Электронное строение:
Электронная формула: 1s22s22p63s23p2
5. Кремний является неметаллом. Высшая и низшая валентности равны IV.
6. Неметаллические свойства кремния выражены сильнее, чем у германия, но
слабее, чем у углерода.
7. Неметаллические свойства кремния выражены слабее, чем у фосфора, но сильнее, чем у алюминия.
8. Неметаллу соответствует высший оксид кремния (IV) – SiO2, значит, это кислотный оксид, и он проявляет все свойства, характерные для этих оксидов: он реагирует с основными оксидами и основаниями с образованием соответствующих солей. Это подтверждается уравнениями реакции:
SiO2 + K2O => K2SiO3
SiO2 + 2NaOH => Na2SO3 + H2O
9. Высший гидроксид серы – это кремниевая кислота – H2SiO3, она нерастворимая и реагирует со щелочами с образованием растворимой соли и воды. Это подтверждается уравнениями реакции:
H2SiО3 + Ba(OH)2 => BaSiO3 + 2H2O
10. Кремний – неметалл, поэтому имеет летучее водородное соединение – SiH4 – силан.

