- Электроотрицательность
- Ковалентная полярная и неполярная связь
- Механизм образования связи
- познакомиться с понятием «электроотрицательность»
- изучить разновидности ковалентной связи (полярная и неполярная)
- научиться составлять электронные схемы образования химических связей в соединениях с ковалентным типом связи
- Между какими атомами возникает ковалентная связь?
- Какие электроны принимают участие в образовании связи?
- За счёт чего образуется ковалентная связь?
Электроотрицательность
Смещение общих электронных пар к какому-либо из атомов химических элементов при образовании химической связи характеризует величина, которую называют электроотрицательностью (ЭО).
Электороотрицательность — это способность атомов химического элемента смещать к себе общие электронные пары, участвующие в образовании химической связи.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по её убыванию:
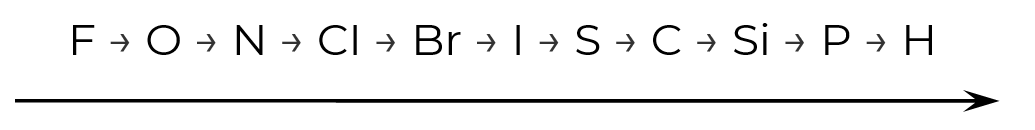
Самый электроотрицательный элемент — фтор, значение его ЭО = 4,0. Это означает, что во всех химических реакциях фтор является окислителем, смещая к себе электронную плотность.
С уменьшением электроотрицательности уменьшается и способность атома смещать общую электронную пару ближе к своему ядру.
Наиболее часто используют ряд электроотрицательности элементов, предложенный американским химиком Л. Полингом.
Таблица электроотрицательности некоторых элементов
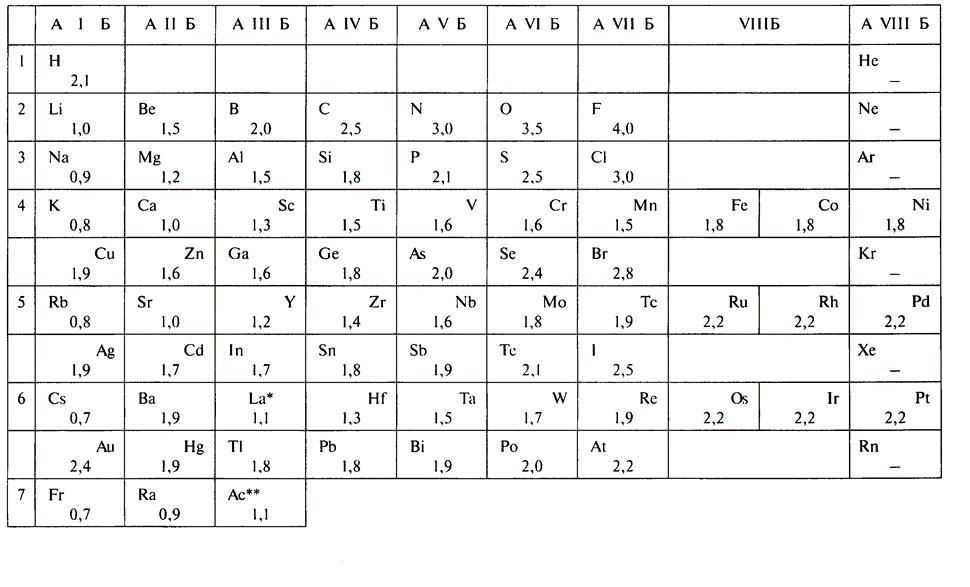
Как меняются значения электроотрицательности в периодической системе?
В периоде — значение ЭО увеличивается слева направо.
В группе главной подгруппе — значение ЭО уменьшается сверху вниз.
Таким образом, металлы имеют более низкое значение электроотрицательности, чем неметаллы.
Ковалентная полярная и неполярная связь
Как мы уже знаем, неметаллы соединяются друг с другом ковалентной связью, и в зависимости от значений ЭО будет меняться и степень смещения валентных электронов между атомами.
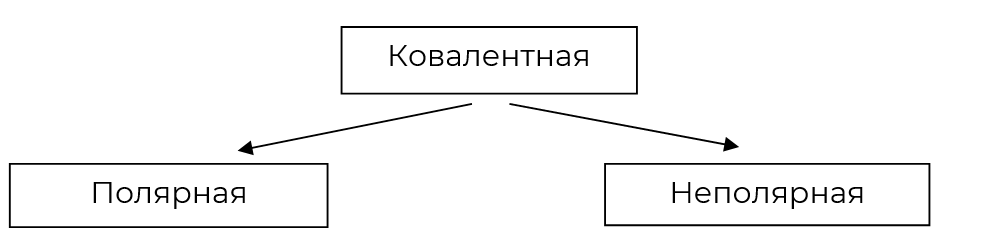
По данной степени смещённости общих электронных пар к одному из связанных ими атомов ковалентная связь делится:
|
Полярная
|
Неполярная
|
|
Ковалентная полярная связь (КПС) — осуществляется между атомами разных химических элементов неметаллов. Если сила атомов различная, их ЭО различная, то связь смещается в сторону более сильного атома, т. е. атома с большим значением ЭО ().
|
Ковалентная неполярная связь (КНС) — существует между атомами одного и того же химического элемента неметалла с помощью образования общих электронных пар. Электронная пара принадлежит в равной мере обоим атомам ().
|
Механизм образования связи
Ковалентная неполярная связь (КНС)
Рассмотрим схему образования молекулы водорода .
Атомы водорода образуют связь, осуществляемую общей для них электронной парой, для достижения наиболее стабильной электронной конфигурации, которую можно представить следующим образом:
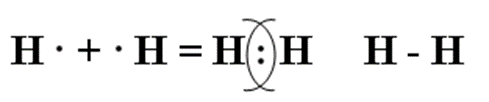
Связь между двумя атомами образуется тогда, когда они приближаются друг к другу на расстояние, достаточное для того, чтобы электроны каждого из них оказались в пределах взаимодействия с ядром другого атома.
Ковалентная полярная связь (КПС)
Рассмотрим схему образования молекулы хлороводорода .
Каждый атом неметалла отдаёт в общее пользование другому атому свои наружные не спаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к хлору как более электроотрицательному элементу.
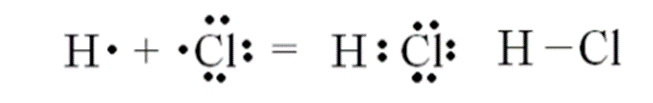
Пример 1
Составим формулу и определим тип химической связи в молекуле йодоводорода.
— йодоводород, молекула образована атомами разных элементов неметаллов, у атома водорода на последнем уровне 1 электрон, в атоме йода — 7 электронов. Т. к. йод более электроотрицательный элемент, он притягивает к себе общую электронную пару. Связь, которая образуется в молекуле, — ковалентная полярная.
Электронная формула молекулы йодоводорода:
••
•• ••
••
Структурная формула молекулы йодоводорода:
Пример 2
Составим формулу и определим тип химической связи в молекуле азота.
— азот, молекула образована атомами одного и того же химического элемента неметалла. Т. к. значение ЭО одинаково для атомов, электронная плотность равномерно распределена между атомами азота. Связь — ковалентная неполярная.
Электронная формула молекулы азота:
••
•• •• ••
••
Структурная формула молекулы азота:
.
Упражнение
Составьте электронные и структурные формулы следующих соединений, укажите тип химической связи:
а) ;
б) .
Контрольные вопросы
- Что называется электроотрицательностью?
- Назовите виды ковалентной связи.
- Как на основе значения ЭО определить тип ковалентной химической связи?
Упражнение
|
а) — бром, связь ковалентная неполярная.
Электронная формула молекулы брома:
•• •• •• •• •• •• •• Структурная формула молекулы брома:
|
б) — вода, связь ковалентная полярная.
Электронная формула молекулы воды:
•• H •• O •• •• H Структурная формула молекулы воды:
|
