- Взаимодействие атомов элементов-металлов между собой
- Металлическая связь, механизм её образования
- Свойства веществ, образованных металлической связью
- выяснить, как взаимодействуют между собой атомы элементов-металлов
- сформировать понятие о металлической связи, изучить механизм образования металлической химической связи
- познакомиться со свойствами веществ, образованных металлической связью
- Какие типы химической связи вам известны?
- Какая связь называется ионной?
- Что такое ковалентная связь?
- Какие виды ковалентной связи вы знаете? Как их можно различить между собой?
Взаимодействие атомов элементов-металлов между собой
Мы уже знаем, как взаимодействуют между собой атомы элементов-металлов и элементов-неметаллов, а также атомы элементов-неметаллов между собой.
Теперь познакомимся с тем, как взаимодействуют между собой атомы элементов-металлов.
Металлы обычно существуют не в виде изолированных атомов, а в форме слитка, куска или металлического изделия. Что же удерживает атомы металла в этом едином объёме?
Давайте вспомним особенности строения атомов металлов: атомы большинства металлов на внешнем уровне содержат 1, 2, 3 электрона, которые они легко отдают при образовании связи.
Но возникает вопрос, кому атомы металлов отдают электроны, если рядом нет атомов неметаллов, которые могли бы их принять?
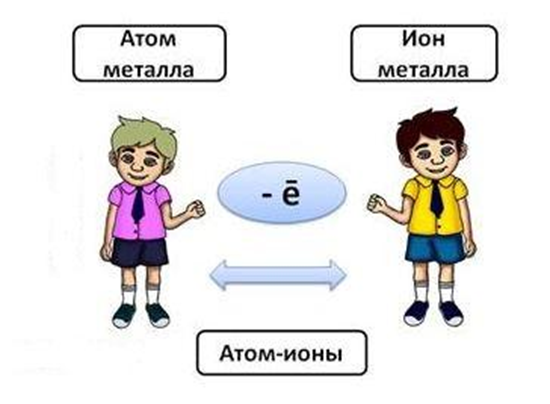
В слитке металлического изделия атомы металлов отдают свои внешние электроны в этот слиток, в общее пространство, превращаясь при этом в положительные ионы. Отданные электроны перемещаются от одного иона к другому, связывая их в единое целое. Ионы, принимая электроны, вновь превращаются в атомы, затем электроны вновь отрываются от атомов и так до бесконечности, этот процесс протекает непрерывно.
В куске металла постоянно существуют атомы, ионы (положительно заряженные) и свободные электроны. Где какие электроны, разобрать невозможно, они все общие, поэтому их называют обобществлённые.
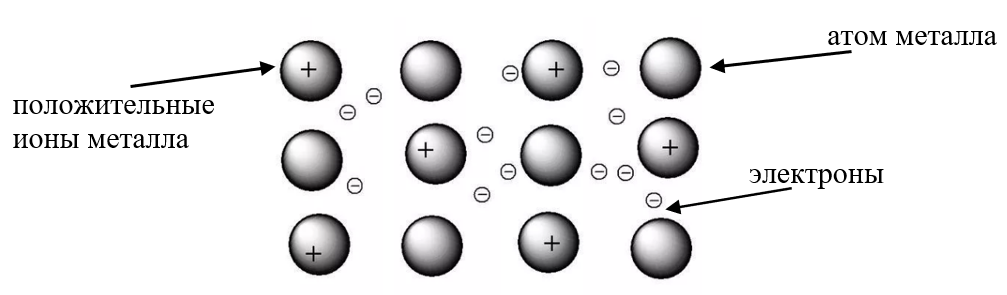 Рис. 1. Образование металлической связи
Рис. 1. Образование металлической связи
Таким образом, получается, что в атомах металлов возникает металлическая химическая связь.
Металлическая связь, механизм её образования
Металлическая связь — связь в металлах между атомами и ионами, образованная за счёт обобществления электронов.
Схему образования металлической связи можно записать следующим образом:
.
Металлическая связь имеет некоторое сходство с ковалентной связью, так как основана на обобществлении внешних электронов. Однако при образовании ковалентной связи обобществляются внешние неспаренные электроны только двух соседних атомов, а при образовании металлической связи в обобществлении этих электронов участвуют все атомы.
Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов — сплавов, находящихся в твёрдом и жидком состоянии.
 Рис. 2. Сплавы металлов: а — сталь (на основе Fe и C); б — бронза (Cu, Pb, Sn); в — латунь (Cu, Zn)
Рис. 2. Сплавы металлов: а — сталь (на основе Fe и C); б — бронза (Cu, Pb, Sn); в — латунь (Cu, Zn)
Пары металлов состоят из отдельных молекул (одноатомных и двухатомных). Атомы металлов связаны между собой ковалентной связью. Например, парами натрия заполнены лампы жёлтого цвета для уличных фонарей. Натрий в газообразном состоянии образует двухатомные молекулы.
Свойства веществ, образованных металлической связью
Металлическая связь обуславливает основные свойства металлов:
- Металлический блеск — свет поглощается металлом, электроны начинают испускать свои волны излучения (лучше других отражают свет Ag, Cu, Al, Pd, Hg).
- Ковкость и пластичность — свойство металлов, характеризующее их способность к обработке деформированием: ковкой, вальцеванием, штамповкой без разрушения, электроны смягчают перемещение ионов под внешним воздействием (самыми пластичными являются Au, Ag, Cu).
- Тепло- и электропроводность — электроны движутся в объёме металла беспорядочно. Но даже небольшой разности потенциалов достаточно, чтобы электроны начали двигаться упорядоченно (лучшими проводниками тока являются Ag, Cu, Au, Al).
Контрольные вопросы
- Что такое металлическая связь? Какие частицы участвуют в её образовании?
- Для каких веществ характерна металлическая связь?
- Как образуется металлическая связь?
- Какими свойствами обладают вещества с металлической химической связью?

