- Атомы, молекулы, ионы
- История открытия и изучения атома
- Атомно-молекулярное учение
- Разнообразие веществ, аллотропия
- Вещества молекулярного и немолекулярного строения
- систематизировать знания об атомах, молекулах и ионах
- сформировать знания о развитии и создании атомно-молекулярного учения
- изучить основные положения атомно-молекулярного учения (АМУ)
- познакомиться с явлением аллотропии веществ
Введение
…Начала вселенной — атомы и пустота. Атомы не поддаются никакому воздействию, которое бы изменило их…
Демокрит
Однажды созданная материя не увеличивается и не уменьшается. Материя не возникает вновь и не исчезает, она может лишь подвергаться изменениям.
Аристотель
История открытия и изучения атома
Представление о том, что вещество состоит из отдельных, очень маленьких
частиц, — атомная гипотеза — возникло ещё в Древней Греции. Однако создание научно обоснованного атомно-молекулярного учения стало возможным значительно позже, в ХVIII–XIX веках, когда физика стала базироваться на точном эксперименте. В химию количественные методы исследования были введены
М. В. Ломоносовым во второй половине ХVIII века.
В 1636 году французский учёный Пьер Гассенди ввел в науку понятие «молекула» (от лат. moles — масса, с уменьшительным суффиксом — cula), что означает «чрезвычайно маленькая масса».
Молекула — наименьшая частица простого и сложного вещества, обладающая его химическими свойствами.
Состав вещества выражается химической формулой, для каждого вещества она одна единственная. Но учёные считали так до того момента, пока не был открыт закон постоянства состава веществ: вещество имеет строго определённый состав независимо от способа получения и места нахождения.
Атомно-молекулярное учение
Из чего состоят вещества? Почему существуют разные вещества и почему одни могут превращаться в другие?
На поиск ответов этих сложных вопросов наука потратила больше 2000 лет. Результатом этих трудов явилась атомно-молекулярная теория.
В 1741 г. в одной из своих первых работ «Элементы математической химии»
М. В. Ломоносов сформулировал важнейшие положения атомно-молекулярной теории.
Он рассматривал строение веществ не как определённую комбинацию атомов, а как сочетание более крупных частиц — корпускул, которые состоят из более мелких частиц — элементов. Через 67 лет в 1808 году английский учёный Джон Дальтон выдвинул атомную гипотезу.
Основные положения атомно-молекулярного учения
1. Все вещества состоят из молекул. Молекула — наименьшая частица вещества, обладающая его химическими свойствами.
2. Молекулы состоят из атомов.
Понятие «атом» было введено в Греции ещё в V веке до нашей эры. Философ Левкипп (500–440 до н. э.) задался вопросом, можно ли каждую часть материи, какая бы малая она не была, разделить на ещё более мелкие части. Левкипп считал, что в результате такого деления можно получить настолько малую частицу, что дальнейшее деление станет невозможным.
Ученик Левкиппа — философ Демокрит (460–370 до н. э.) назвал эти маленькие частицы «атомами» (атомос — неделимый). Он считал, что атомы каждого элемента имеют особые размеры и форму и что именно этим объясняются различия в свойствах химических элементов. Вещества, которые мы видим и ощущаем, представляют собой соединения атомов различных элементов, и, изменив природу этого соединения, можно одно вещество превратить в другое.
Атом — наименьшая частица химического элемента, сохраняющая все его свойства.
3. При физических явлениях молекулы сохраняются, а при химических — распадаются. При физических явлениях молекулы не изменяются — изменяется агрегатное состояние.
Агрегатное состояние зависит как от вида частиц (атомы, молекулы), так и от вида связи между этими частицами.
При химических реакциях молекулы разрушаются, поэтому они являются химически делимыми частицами. Атомы в химических реакциях не делятся. Новые вещества образуются из тех атомов, из которых состояли исходные вещества.
Например, при пропускании электрического тока через воду происходит образование новых веществ — кислорода и водорода. При распаде молекулы воды атомы остались неизменными. Атом кислорода и атом водорода заново перегруппировались с образованием новых веществ.
То же самое происходит при любом химическом процессе: молекулы разрушаются, но атомы остаются неизменными.
Химический элемент — определённый вид атомов.
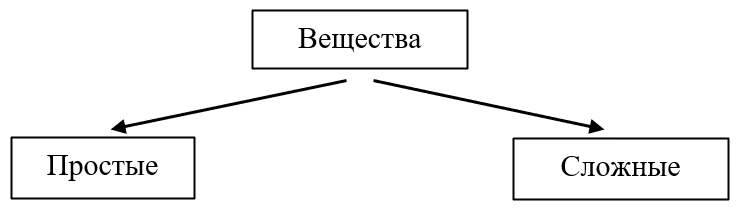
Разнообразие веществ, аллотропия
|
Простые
|
Сложные
|
|
Вещества, образованные атомами одного химического элемента. Пример: металлы, фосфор, кислород, азот, сера.
|
Вещества, которые образованы атомами нескольких химических элементов. Пример: вода, углекислый газ, серная кислота.
|
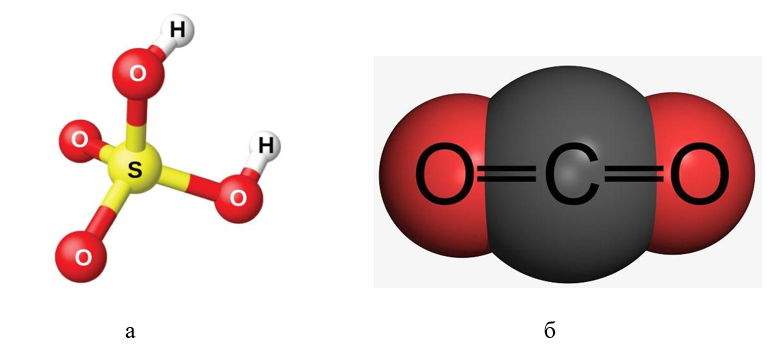 Рис. 1. Сложные вещества: а — молекула серной кислоты; б — молекула углекислого газа
Рис. 1. Сложные вещества: а — молекула серной кислоты; б — молекула углекислого газа
Из известных на данный момент 118 химических элементов в природе встречаются 90. Названия химических элементов часто совпадают с названием простых веществ. Тогда логично предположить, что и простых веществ должно быть 90. Однако это не так, известно более 200 простых веществ.
В чём же причина такого многообразия простых веществ? Оказывается, атомы одного и того же химического элемента могут соединяться в разные молекулы, образовывать разные вещества.
Аллотропия — явление, когда один и тот химический элемент может образовывать несколько простых веществ. Эти вещества называются аллотропные модификации.
 Рис. 2. Аллотропные модификации серы: а — ромбическая; б — моноклинная; в — пластическая
Рис. 2. Аллотропные модификации серы: а — ромбическая; б — моноклинная; в — пластическая
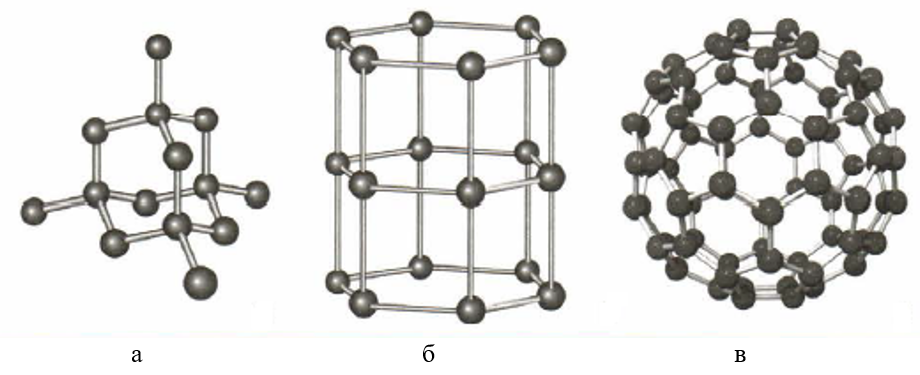 Рис. 3. Модели аллотропных модификаций углерода: а — алмаз; б — графит; в — фуллерен
Рис. 3. Модели аллотропных модификаций углерода: а — алмаз; б — графит; в — фуллерен
Свойства аллотропных модификаций одного химического элемента различны.
Одной из причин аллотропии может служить разный количественный состав, т. е. разное число атомов в молекулах простых веществ. Другой причиной является различное кристаллическое строение аллотропных модификаций.
Сложных веществ гораздо больше, чем простых. Число известных химических соединений превышает 100 миллионов. Подобно буквам алфавита, которые образуют различные варианты слов, так и из химических элементов природа и человек создали всё многообразие мира веществ.
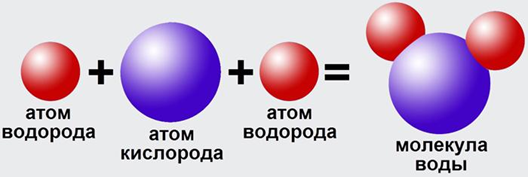 Рис. 4. Образование молекулы воды
Рис. 4. Образование молекулы воды
Вещества молекулярного и немолекулярного строения
Из курса физики вам известно, что многие вещества состоят не из атомов и молекул, а из ионов.
Ионы — положительно или отрицательно заряженные частицы, которые образуются из атомов или групп атомов.
Таким образом, вещества могут быть молекулярного и немолекулярного строения.
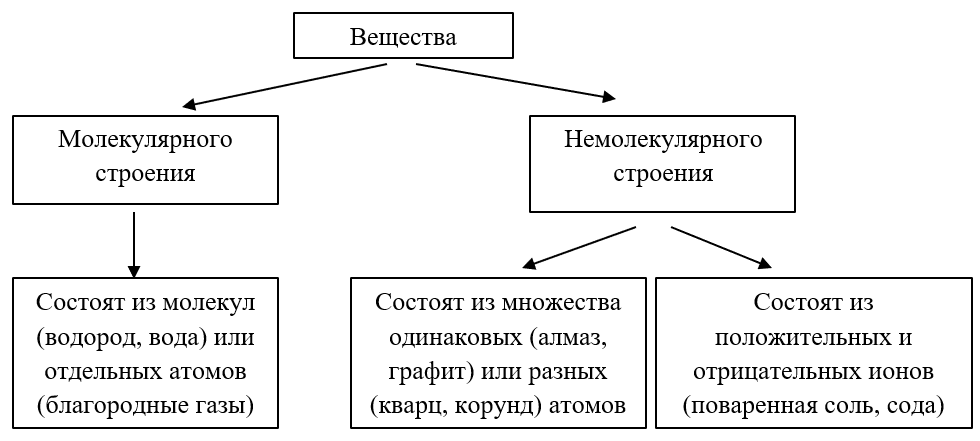
Из атомов состоят:
- все металлы;
- многие неметаллы (инертные газы, С, Si, B, Se, As, Te).
Из молекул состоят:
- все органические вещества;
- некоторые неорганические:
- простые газы (N2, H2, Cl2, F2),
- сложные (CO2, NO2, SO3, SO2).
Из ионов состоят:
- все соли;
- многие основания, кислоты.
С помощью атомно-молекулярного учения химия стала действительно наукой. В настоящее время на атомно-молекулярном учении базируются все наши представления о строении материи, о свойствах веществ и о природе физических и химических явлений.
Контрольные вопросы
- Дайте определение атому, молекуле, иону.
- Какой учёный в 1741 году сформулировал основы атомно-молекулярного учения?
- Почему с точки зрения атомно-молекулярного учения недопустимо выражение «атомы воды»?
- Что такое аллотропия?
- Сравните по физическим свойствам аллотропные модификации углерода: алмаз и графит.

