- Агрегатное состояние веществ
- Твёрдое, жидкое, газообразное
- Взаимопревращения веществ
- научиться описывать физические свойства веществ на основе представлений о молекулярном строении вещества
- объяснить различные агрегатные состояния вещества, условия протекания процессов превращения веществ и связанные с ними явления
- сформировать представление о таких процессах, как плавление и кристаллизация, испарение и конденсация, возгонка и десублимация
Я и туча, и туман,
И ручей, и океан,
И летаю, и бегу,
И стеклянной быть могу!
- О каких состояниях воды говорится в этой загадке?
- При каких условиях вода может превращаться в пар? А в лёд?
- Одинаковыми ли физическими свойствами обладает вода в разных физических состояниях?
Агрегатное состояние веществ
Оглянитесь вокруг: нас с вами окружают различные тела. Тела, в свою очередь, состоят из различных веществ.
В зависимости от условий одно и то же вещество может находиться в трёх агрегатных состояниях.
Агрегатное состояние вещества — состояние одного и того же вещества, переходы между которыми сопровождаются скачкообразными изменениями плотности.
В разных агрегатных состояниях расположение атомов и молекул, из которых состоят вещества, различно, внутренняя энергия одинаковых масс твёрдого тела, жидкости и газа при одинаковых температурах тоже различается.
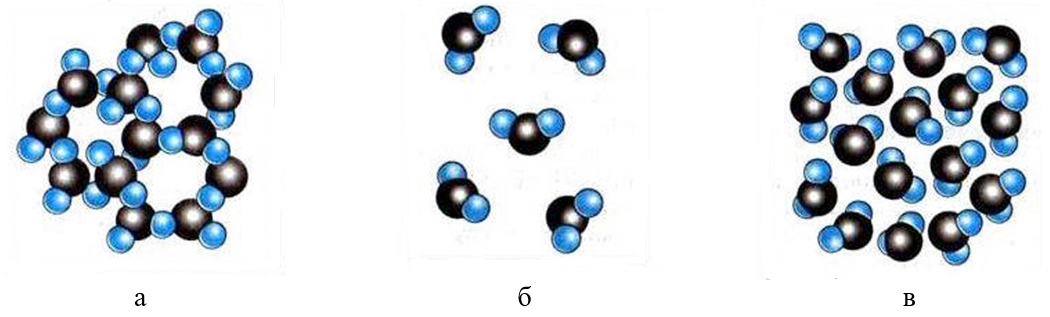 Рис. 1. Пример расположения молекул воды в различных агрегатных состояниях: а — твёрдое (лёд); б — газообразное (водяной пар); в — жидкое (вода)
Рис. 1. Пример расположения молекул воды в различных агрегатных состояниях: а — твёрдое (лёд); б — газообразное (водяной пар); в — жидкое (вода)
От расположения молекул в веществе, а также от их движения, зависит, в каком агрегатном состоянии находится вещество и какими свойствами оно обладает.
Твёрдое, жидкое, газообразное
Таблица 1. Свойства веществ разных агрегатных состояний
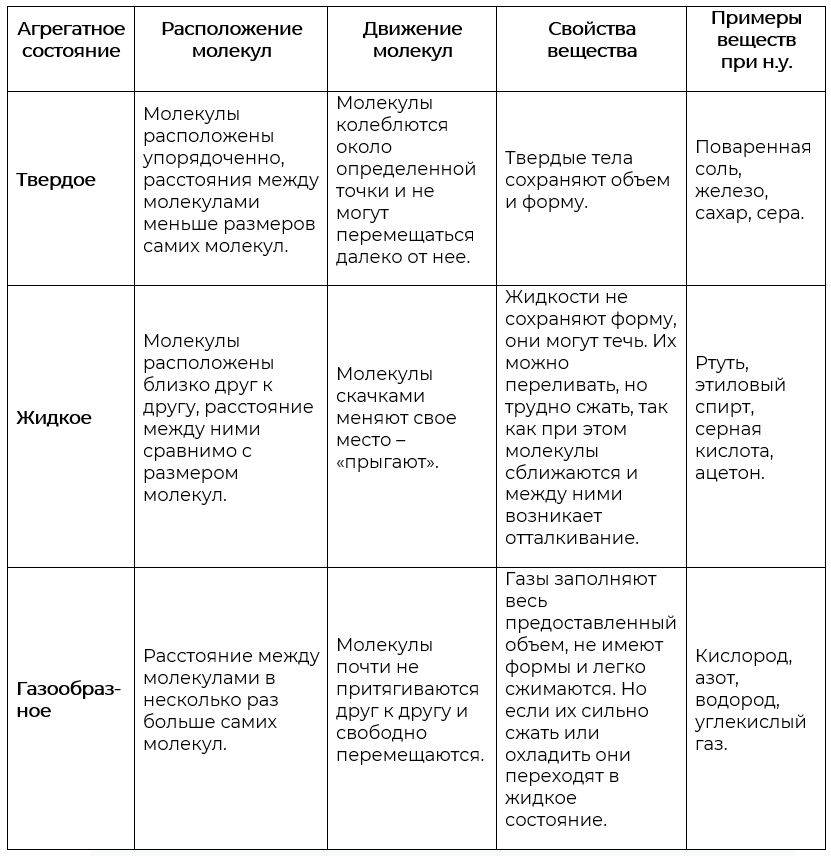
Наиболее характерным свойствами газов являются:
- сжимаемость,
- способность расширяться.
Газы не имеют собственного объёма, объём газа определяется объёмом сосуда, в котором находится газ. Газы также не имеют собственной формы и расширяются до тех пор, пока не заполнят весь сосуд, принимая его форму.
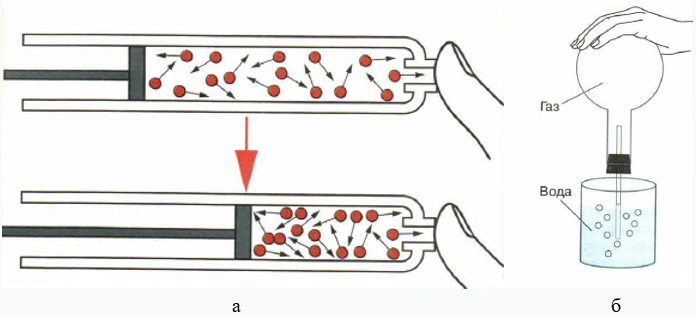 Рис. 2. а — сжимаемость газов; б — увеличение объёма газа при нагревании, используют для проверки прибора на герметичность
Рис. 2. а — сжимаемость газов; б — увеличение объёма газа при нагревании, используют для проверки прибора на герметичность
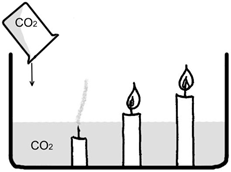 Рис. 3. «Переливание» CO2
Рис. 3. «Переливание» CO2
Газообразные вещества кажутся невесомыми, но понятие «невесомость» газов весьма относительное.
В этом легко убедиться во время опыта «Переливание» углекислого газа из колбы в колбу».
Углекислый газ — бесцветный, тяжелее воздуха, при «переливании» его в колбу с горящими свечами, по мере её заполнения углекислым газом, свечи будут гаснуть одна за одной.
Взаимопревращения веществ
При определённых условиях вещества могут переходить из одного агрегатного состояния в другое. Такие переходы представляют собой физическое явление.

 Рис. 4. Кислород: а — твёрдый, б — жидкий
Рис. 4. Кислород: а — твёрдый, б — жидкий
Так, например, кислород, при н. у. (нормальных условиях) — газ без цвета и запаха, плохо растворим в воде.
При температуре −183 оС кислород переходит в жидкое агрегатное состояние. Жидкий кислород — вещество голубого цвета.
При температуре −219 оС кислород затвердевает. Твёрдый кислород — вещество синего цвета.
Плавление — это процесс перехода вещества из твёрдого состояния в жидкое.
Температуру, при которой вещество плавится, называют температурой плавления.
При плавлении вещества энергия поглощается, вещество получает энергию.
Кристаллизация (отвердевание) — процесс перехода вещества из жидкого состояния в твёрдое (процесс обратный плавлению).
Температура, при которой вещество отвердевает (кристаллизуется), называют температурой отвердевания или кристаллизации.
При кристаллизации вещество, наоборот, выделяет энергию в окружающую среду.
Поэтому обычно при снегопаде становится теплее, окружающая среда нагревается от энергии, выделяющейся при кристаллизации. Это хорошо известно многим животным, например птицам. Недаром их можно заметить зимой во время мороза сидящими на льду, который покрывает реки и озёра. Из-за выделения энергии при образовании льда воздух над ним оказывается на несколько градусов теплее, чем в лесу на деревьях, птицы этим пользуются.
Испарение — процесс превращения жидкости в газ, когда некоторые частицы жидкости способны преодолевать силы межмолекулярного притяжения.
При увеличении температуры число таких частиц становится всё больше, а испарение — интенсивнее. Наконец, при определённой температуре испарение становится настолько интенсивным, что жидкость закипает. Эта температура называется температурой кипения вещества.
Конденсация — превращение вещества из газообразного состояния в жидкое.
Этот процесс происходит в воздухе, насыщенном паром, при понижении температуры или изменении давления атмосферы, над водой и земной поверхностью, на предметах и растениях. Конденсация идёт с выделением энергии.
 Рис. 5. Медицинский йод
Рис. 5. Медицинский йод
Сублимация (возгонка) — переход из твёрдого агрегатного состояния в газообразное, минуя жидкое.
Возгонка характерна, например, для всем нам известного вещества — йода, который при н. у. не имеет жидкого агрегатного состояния (медицинский йод — спиртовой раствор йода).
Поддаётся возгонке также и вода, поэтому бельё после стирки можно высушить и на морозе.
Десублимация — превращение газообразного вещества в твёрдое.
Примером этого процесса может служить образование инея, когда водяной пар, содержащийся в атмосфере, превращается в кристаллики льда, которые оседают на холодных ветвях деревьев и проводах.
Каждое вещество, в зависимости от условий, может находиться в одном из трёх агрегатных состояниях.
Вещество из одного агрегатного состояния может переходить в другое. Такие переходы играют важную роль не только в природе, но и в технике. Так, например, превратив воду в пар, люди используют его затем в паровых турбинах на электростанциях. Расплавляя металлы на заводах, человек получает возможность изготовить из них различные сплавы: сталь, чугун, латунь.
Контрольные вопросы
- В сказке про Алладина Джинн, то вылезая из бутылки, то влезая обратно, постоянно меняет свои форму и объём. В каком же состоянии находится Джинн?
- В кипящий чайник бросили крупный кусок льда. Быстро, пока лёд не растаял, скажите, в каких состояниях находится вода в чайнике?
- Вода испарилась и превратилась в пар. Изменились ли при этом сами молекулы? Как изменилось их расположение?

