- Необратимость реакции
- Обратимость реакции
- Химическое равновесие
- Принцип Ле Шателье
- иметь представление о процессе обратимости
- уметь составлять обратимые и необратимые реакции
- знать способы смещения равновесия
- уметь применять способы смещения равновесия для химических процессов
Вы уже знаете, что химия изучает не только свойства веществ, но и их превращения, а также стремится использовать такие процессы для получения соединений с новыми, полезными для человека свойствами. Имеются достаточно большие группы реакций, одни из которых не сопровождаются изменением состава вещества, а другие протекают с изменением состава вещества. Последняя группа химических реакций тоже делится по различным признакам: изменению числа, состава реагентов и продуктов реакции; выделению или поглощению теплоты; изменению степеней окисления атомов, образующих вещества, направлению процесса; использованию катализатора; агрегатному состоянию веществ. Направление реакции может быть как прямым, так и обратным. Соответственно и реакции могут быть как обратимыми, так и необратимыми.
Необратимость реакции
Вы уже знаете, что существуют химические реакции, которые протекают только в одном направлении — в сторону образования продуктов реакции. Такие реакции называются необратимыми.
Необратимая реакция — это определённая химическая реакция, которая идёт до конца в одном конкретном направлении.
В этих реакциях исходные вещества (реагенты) практически полностью превращаются в стехиометрическом соотношении в продукты реакции. Необратимости реакции способствуют условия, при которых хотя бы один из продуктов реакции уходит из реакционной зоны в виде осадка или газообразного вещества или представляет собой малодиссоциирующее в реакционной среде вещество.
Рассмотрим пример необратимой реакции.
Пример 1
Написать реакцию взаимодействия между нитратом серебра и хлоридом натрия.
Решение
1. Записать реакцию между нитратом серебра и хлоридом натрия. Уравниваем и отмечаем растворимость:
.
Н P Н Р
Реакция протекает с выпадением осадка, значит относится к необратимым
2. Записать реакцию в полном ионном виде:
.
3. Записать сокращённое ионное уравнение:
.
Необратимую реакцию нельзя повернуть в обратную сторону без ввода новых реагентов и без затраты энергии.
Аналогично можно рассмотреть и электролитическую диссоциацию. Так, сильные электролиты диссоциируют необратимо:
.
Эту особенность отражают с помощью стрелок. При необратимом процессе используется одна стрелка, указывающая справа налево, а при обратимых — две стрелки, направленные в противоположные стороны. Таким образом, стрелка, указывающая слева направо, отражает процесс диссоциации, а в обратном направлении — ассоциации.
Если сильные электролиты участвуют в необратимом процессе, то слабые, в свою очередь, — в обратимом:
.
Обратимость реакции
Процесс электролиза расплавов протекает при участии молекул воды, которые не всегда остаются безразличными к воздействию электрического разряда на электродах. Процессы электролиза для различных типов солей на катоде и аноде протекают неодинаково. Рассмотрим эти процессы. В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей.
Окислительные способности
Существует множество реакций, которые не идут до полного превращения реагентов в продукты, взаимодействие как бы прекращается на определённом этапе. В реакционной смеси обнаруживаются как продукты реакции, так и исходные вещества. На самом деле реакция не прекращается, а только с определённого момента продукты реакции начинают взаимодействовать и выделять исходные вещества, а значит, начинает протекать обратная реакция. Такие реакции называются обратимыми.
Обратимыми называются реакции, которые при данных условиях одновременно протекают в двух взаимно противоположных направлениях.
Рассмотрим пример обратимой реакции.
Пример 2
Написать реакцию образования оксида азота (II).
Решение
1. Запишем реакцию между азотом и кислородом:
.
2. Запишем окислительно-восстановительный процесс этой реакции:
4 1 восстановитель,
4
4 1 окислитель.
3. Расставим коэффициенты: .
Две противоположно направленные стрелки указывают на то, что при одних и тех же условиях одновременно протекает как прямая, так и обратная реакция.
Обратимые реакции могут протекать одновременно в двух противоположных направлениях и не заканчиваются полным расходованием всех либо одного из исходных веществ, поэтому вместо знака равенства «=» или «=>» в уравнениях таких реакций ставится знак обратимости «⇆» или «↔».
Контрольные вопросы
1. Что заключается в понятии «обратимость»?
2. В чём отличие процессов ассоциации и диссоциации?
3. Почему процессам электролитической диссоциации также присуще понятие обратимости?
Упражнение 1
Обратимой или необратимой является реакция взаимодействия ? Почему? Закончите реакцию.
Химическое равновесие
Скорость химической реакции прямо пропорционально зависит от концентрации исходных веществ: чем выше (больше) концентрация веществ, тем больше скорость реакции и наоборот, чем ниже концентрация веществ, тем меньше скорость реакции.
Так, в обратимых реакциях в результате протекания прямой реакции в системе появляются и начинают накапливаться конечные продукты реакции, которые по мере накопления начинают вступать в противоположную по направлению (обратную) реакцию, идущую справа налево. Следовательно, в соответствии с законом действующих масс в реакционной системе скорость прямой реакции постепенно уменьшается, а скорость обратной реакции увеличивается.
В результате через какое-то время эти скорости станут равными, и устанавливается состояние, именуемое химическим равновесием.
Химическим равновесием называют такое состояние системы, при котором скорость прямой реакции равна скорости обратной реакции.
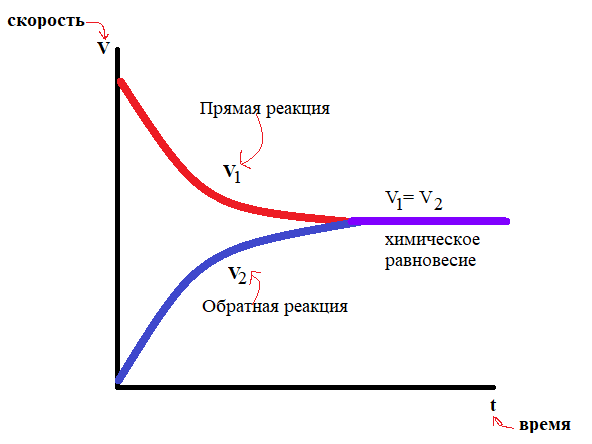
При этом концентрации реагирующих веществ и продуктов реакции остаются без изменения. Их называют равновесными концентрациями. На макроуровне кажется, что в целом ничего не изменяется. Но на самом деле и прямой, и обратный процессы продолжают идти, но с равной скоростью.
Поэтому такое равновесие в системе называют подвижным и динамическим.
Принцип Ле Шателье (смещение химического равновесия)
Химическое равновесие является подвижным. При изменении внешних условий скорости прямой и обратной реакций могут стать неодинаковыми, что обусловливает смещение (сдвиг) равновесия.
 Рис. 1. Анри Луи Ле Шателье
Рис. 1. Анри Луи Ле Шателье
Направление смещения равновесия определяется принципом, который был сформулирован французским учёным Ле Шателье в 1884 году.
Если на равновесную систему оказывается внешнее воздействие, то равновесие смещается в сторону той реакции (прямой или обратной), которая противодействует этому воздействию.
Этот принцип часто называют принципом «бегства от насилия» или принципом «наоборот». Принцип Ле Шателье применим не только к химическим реакциям, но и ко многим другим процессам: к испарению, конденсации, плавлению, кристаллизации и др. При производстве важнейших химических продуктов принцип Ле Шателье и расчёты, вытекающие из закона действующих масс, дают возможность находить такие условия для проведения химических процессов, которые обеспечивают максимальный выход желаемого вещества.
Важнейшими внешними факторами, которые могут приводить к смещению химического равновесия, являются: концентрации реагирующих веществ, температура, давление.
Выделим основные закономерности:
- при увеличении концентрации реагирующих веществ химическое равновесие системы смещается в сторону образования продуктов реакции;
- при увеличении концентрации продуктов реакции химическое равновесие системы смещается в сторону образования исходных веществ;
- при увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объём образующихся газообразных веществ меньше;
- при повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции;
- при понижении температуры — в сторону экзотермического процесса.
Рассмотрим пример реакции образования аммиака.
Пример 3
Написать реакцию образования аммиака из водорода и азота.
Решение
Давайте рассмотрим, как идёт процесс образования аммиака.
1. Запишем реакцию. Уравняем и установим, обратимая или необратимая реакция.
Оба вещества газообразные, не происходит образования осадка или воды, соответственно реакция обратимая.
2. Задача: увеличить выход продукта реакции.
3. Решение: необходимо повышать давление в системе обратимой реакции, так как при протекании прямой реакции число газообразных молекул уменьшается (из четырёх молекул газов азота и водорода образуются две молекулы газа аммиака).
Контрольные вопросы
1. Что заключается в понятии «скорость химической реакции»?
2. Что обозначают понятия «экзотермический и эндотермический процесс»?
3. Почему в необратимых реакциях нельзя сместить равновесие путём увеличения давления?
Упражнение 1
В примере 3 указан один из способов повышения выхода продукта реакции . Запишите остальные способы смещения равновесия в сторону продуктов реакции.
Ответы
Упражнение 1
Реакция необратимая, т. к. в ней выделяется угарный газ и вода, которые при н. у. не взаимодействуют друг с другом.
Упражнение 2
1. Чтобы сместить равновесие вправо в реакции синтеза аммиака
, т. е. увеличить выход аммиака, необходимо:
1) повысить концентрацию ;
2) понизить концентрацию (отводить продукт из сферы реакции);
3) понизить температуру, т. к. прямая реакция экзотермическа.
- Необратимость реакции
- Обратимость реакции
- Химическое равновесие
- Принцип Ле Шателье
- иметь представление о процессе обратимости
- уметь составлять обратимые и необратимые реакции
- знать способы смещения равновесия
- уметь применять способы смещения равновесия для химических процессов
Вы уже знаете, что химия изучает не только свойства веществ, но и их превращения, а также стремится использовать такие процессы для получения соединений с новыми, полезными для человека свойствами. Имеются достаточно большие группы реакций, одни из которых не сопровождаются изменением состава вещества, а другие протекают с изменением состава вещества. Последняя группа химических реакций тоже делится по различным признакам: изменению числа, состава реагентов и продуктов реакции; выделению или поглощению теплоты; изменению степеней окисления атомов, образующих вещества, направлению процесса; использованию катализатора; агрегатному состоянию веществ. Направление реакции может быть как прямым, так и обратным. Соответственно и реакции могут быть как обратимыми, так и необратимыми.
Необратимость реакции
Вы уже знаете, что существуют химические реакции, которые протекают только в одном направлении — в сторону образования продуктов реакции. Такие реакции называются необратимыми.
Необратимая реакция — это определённая химическая реакция, которая идёт до конца в одном конкретном направлении.
В этих реакциях исходные вещества (реагенты) практически полностью превращаются в стехиометрическом соотношении в продукты реакции. Необратимости реакции способствуют условия, при которых хотя бы один из продуктов реакции уходит из реакционной зоны в виде осадка или газообразного вещества или представляет собой малодиссоциирующее в реакционной среде вещество.
Рассмотрим пример необратимой реакции.
Пример 1
Написать реакцию взаимодействия между нитратом серебра и хлоридом натрия.
Решение
1. Записать реакцию между нитратом серебра и хлоридом натрия. Уравниваем и отмечаем растворимость:
.
Н P Н Р
Реакция протекает с выпадением осадка, значит относится к необратимым
2. Записать реакцию в полном ионном виде:
.
3. Записать сокращённое ионное уравнение:
.
Необратимую реакцию нельзя повернуть в обратную сторону без ввода новых реагентов и без затраты энергии.
Аналогично можно рассмотреть и электролитическую диссоциацию. Так, сильные электролиты диссоциируют необратимо:
.
Эту особенность отражают с помощью стрелок. При необратимом процессе используется одна стрелка, указывающая справа налево, а при обратимых — две стрелки, направленные в противоположные стороны. Таким образом, стрелка, указывающая слева направо, отражает процесс диссоциации, а в обратном направлении — ассоциации.
Если сильные электролиты участвуют в необратимом процессе, то слабые, в свою очередь, — в обратимом:
.
Обратимость реакции
Процесс электролиза расплавов протекает при участии молекул воды, которые не всегда остаются безразличными к воздействию электрического разряда на электродах. Процессы электролиза для различных типов солей на катоде и аноде протекают неодинаково. Рассмотрим эти процессы. В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей.
Окислительные способности
Существует множество реакций, которые не идут до полного превращения реагентов в продукты, взаимодействие как бы прекращается на определённом этапе. В реакционной смеси обнаруживаются как продукты реакции, так и исходные вещества. На самом деле реакция не прекращается, а только с определённого момента продукты реакции начинают взаимодействовать и выделять исходные вещества, а значит, начинает протекать обратная реакция. Такие реакции называются обратимыми.
Обратимыми называются реакции, которые при данных условиях одновременно протекают в двух взаимно противоположных направлениях.
Рассмотрим пример обратимой реакции.
Пример 2
Написать реакцию образования оксида азота (II).
Решение
1. Запишем реакцию между азотом и кислородом:
.
2. Запишем окислительно-восстановительный процесс этой реакции:
4 1 восстановитель,
4
4 1 окислитель.
3. Расставим коэффициенты: .
Две противоположно направленные стрелки указывают на то, что при одних и тех же условиях одновременно протекает как прямая, так и обратная реакция.
Обратимые реакции могут протекать одновременно в двух противоположных направлениях и не заканчиваются полным расходованием всех либо одного из исходных веществ, поэтому вместо знака равенства «=» или «=>» в уравнениях таких реакций ставится знак обратимости «⇆» или «↔».
Контрольные вопросы
1. Что заключается в понятии «обратимость»?
2. В чём отличие процессов ассоциации и диссоциации?
3. Почему процессам электролитической диссоциации также присуще понятие обратимости?
Упражнение 1
Обратимой или необратимой является реакция взаимодействия ? Почему? Закончите реакцию.
Химическое равновесие
Скорость химической реакции прямо пропорционально зависит от концентрации исходных веществ: чем выше (больше) концентрация веществ, тем больше скорость реакции и наоборот, чем ниже концентрация веществ, тем меньше скорость реакции.
Так, в обратимых реакциях в результате протекания прямой реакции в системе появляются и начинают накапливаться конечные продукты реакции, которые по мере накопления начинают вступать в противоположную по направлению (обратную) реакцию, идущую справа налево. Следовательно, в соответствии с законом действующих масс в реакционной системе скорость прямой реакции постепенно уменьшается, а скорость обратной реакции увеличивается.
В результате через какое-то время эти скорости станут равными, и устанавливается состояние, именуемое химическим равновесием.
Химическим равновесием называют такое состояние системы, при котором скорость прямой реакции равна скорости обратной реакции.

При этом концентрации реагирующих веществ и продуктов реакции остаются без изменения. Их называют равновесными концентрациями. На макроуровне кажется, что в целом ничего не изменяется. Но на самом деле и прямой, и обратный процессы продолжают идти, но с равной скоростью.
Поэтому такое равновесие в системе называют подвижным и динамическим.
Принцип Ле Шателье (смещение химического равновесия)
Химическое равновесие является подвижным. При изменении внешних условий скорости прямой и обратной реакций могут стать неодинаковыми, что обусловливает смещение (сдвиг) равновесия.
 Рис. 1. Анри Луи Ле Шателье
Рис. 1. Анри Луи Ле Шателье
Направление смещения равновесия определяется принципом, который был сформулирован французским учёным Ле Шателье в 1884 году.
Если на равновесную систему оказывается внешнее воздействие, то равновесие смещается в сторону той реакции (прямой или обратной), которая противодействует этому воздействию.
Этот принцип часто называют принципом «бегства от насилия» или принципом «наоборот». Принцип Ле Шателье применим не только к химическим реакциям, но и ко многим другим процессам: к испарению, конденсации, плавлению, кристаллизации и др. При производстве важнейших химических продуктов принцип Ле Шателье и расчёты, вытекающие из закона действующих масс, дают возможность находить такие условия для проведения химических процессов, которые обеспечивают максимальный выход желаемого вещества.
Важнейшими внешними факторами, которые могут приводить к смещению химического равновесия, являются: концентрации реагирующих веществ, температура, давление.
Выделим основные закономерности:
- при увеличении концентрации реагирующих веществ химическое равновесие системы смещается в сторону образования продуктов реакции;
- при увеличении концентрации продуктов реакции химическое равновесие системы смещается в сторону образования исходных веществ;
- при увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объём образующихся газообразных веществ меньше;
- при повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции;
- при понижении температуры — в сторону экзотермического процесса.
Рассмотрим пример реакции образования аммиака.
Пример 3
Написать реакцию образования аммиака из водорода и азота.
Решение
Давайте рассмотрим, как идёт процесс образования аммиака.
1. Запишем реакцию. Уравняем и установим, обратимая или необратимая реакция.
Оба вещества газообразные, не происходит образования осадка или воды, соответственно реакция обратимая.
2. Задача: увеличить выход продукта реакции.
3. Решение: необходимо повышать давление в системе обратимой реакции, так как при протекании прямой реакции число газообразных молекул уменьшается (из четырёх молекул газов азота и водорода образуются две молекулы газа аммиака).
Контрольные вопросы
1. Что заключается в понятии «скорость химической реакции»?
2. Что обозначают понятия «экзотермический и эндотермический процесс»?
3. Почему в необратимых реакциях нельзя сместить равновесие путём увеличения давления?
Упражнение 1
В примере 3 указан один из способов повышения выхода продукта реакции . Запишите остальные способы смещения равновесия в сторону продуктов реакции.
Ответы
Упражнение 1
Реакция необратимая, т. к. в ней выделяется угарный газ и вода, которые при н. у. не взаимодействуют друг с другом.
Упражнение 2
1. Чтобы сместить равновесие вправо в реакции синтеза аммиака
, т. е. увеличить выход аммиака, необходимо:
1) повысить концентрацию ;
2) понизить концентрацию (отводить продукт из сферы реакции);
3) понизить температуру, т. к. прямая реакция экзотермическа.



