- Определение реакции гидролиза
- Гидролиз солей. Взаимное усиление гидролиза
- Гидролиз органических веществ
- знать, что такое гидролиз
- уметь определять поведение солей при гидролизе
- уметь записывать уравнения реакций гидролиза
Было бы довольно наивно полагать, что воду, которая в химии так часто используется для приготовления растворов, можно считать химически инертным соединением. Мы уже знаем, что вода обладает довольно большим количеством химических свойств. Среди них — способность реагировать с солями, вступая в реакцию гидролиза.
Помимо гидролиза солей, возможен также и гидролиз других соединений, в том числе и органических: сложных эфиров, жиров, ди- и полисахаридов, пептидов
и т. д.
Реакция гидролиза
Гидролиз — обменная реакция с водой, приводящая к полному или частичному разложению вещества.
По сути реакция гидролиза солей является обратным процессом реакции нейтрализации.
Гидролиз солей протекает обратимо и ступенчато.
Например, реакция гидролиза хлорида цинка — процесс, обратный реакции нейтрализации между гидроксидом цинка и соляной кислоты.
Так, для этой реакции
.
А в ионном виде —
.
Видно, что и в левой и в правой части присутствует слабый электролит, следовательно, протекание реакции возможно как в прямом, так и в обратном направлении.
Пример 1
Выбрать реакцию гидролиза:
- ,
- ,
- .
Решение
Давайте рассмотрим каждое уравнение внимательно.
1. Это реакция с водой, но в данном случае это соединение, а не обмен, поэтому это НЕ гидролиз.
2. Это обмен, но в данном случае вода — продукт этой реакции, следовательно, НЕ гидролиз.
3. Это реакция обмена и в ней участвует вода. Это гидролиз.
Ответ: реакция гидролиза под номером 3.
Обратите внимание, не все соли подвергаются гидролизу.
Упражнение 1
1. Какие реакции называют реакциями гидролиза?
2. Что характерно для реакций гидролиза?
3. Назовите пять любых органических веществ, вступающих в реакцию гидролиза.
Гидролиз солей
В зависимости от того, какими кислотами и основаниями образованы соли, их отношение к гидролизу может быть различным.
В зависимости от поведения солей в воде, их делят на 4 группы, представленные далее.
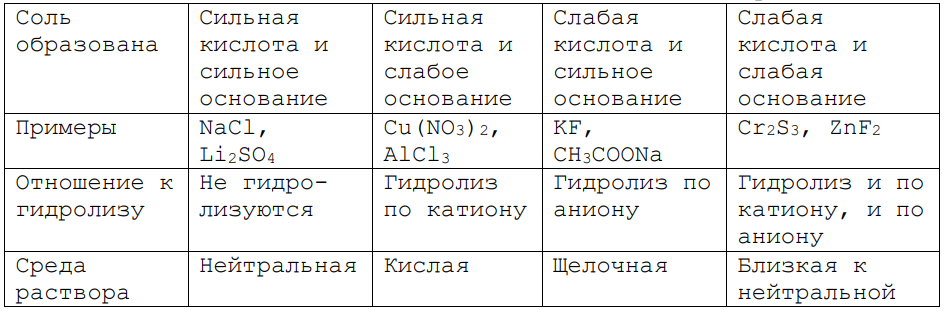 Таблица 1. Гидролиз солей
Таблица 1. Гидролиз солей
Нерастворимые соли не подвергаются гидролизу.
При гидролизе солей могут образовываться кислые и средние соли.
В ионном виде становится наглядной причина изменения среды растворов при гидролизе солей.
При гидролизе по аниону, напротив, образуются гидроксид-ионы, чем и обусловлена щелочная среда.
Пример 2
Определите среду раствора хлорида алюминия и запишите уравнение реакции его гидролиза.
Решение
1. Хлорид алюминия образован сильной (HCl) кислотой и слабым (Al(OH)3) основанием, следовательно, реакция протекает по катиону, среда кислая.
2. Запишем сначала ионное уравнение, только по первой ступени, так как остальными принято пренебрегать.
Как можно видеть, мы должны получить основную соль. Теперь запишем и в молекулярном виде, подставив хлор:
.
Ответ: среда кислая.
В некоторых случаях, когда гидролиз идёт и по катиону, и по аниону, возможно взаимное усиление гидролиза.
Например, как при попадании в раствор сульфида хрома III, так и при смешивании растворов сульфидов и хрома III, будут параллельно происходить следующие процессы:
,
.
В результате этих процессов образуется вода , что способствует протеканию второй и третей ступени гидролиза.
Образование газообразного сероводорода и осадка гидроксида хрома III в результате реакции приводит к тому, что она протекает необратимо. В молекулярном виде получаем:
.
Определить, что происходит взаимное усиление гидролиза, можно по таблице растворимости. У таких солей будет стоять прочерк.
Пример 3
Определите, какой осадок образуется при взаимодействии карбоната калия и нитрата алюминия.
Решение
По таблице растворимости видим, что карбонат алюминия разлагается водой, следовательно, в данном случае происходит взаимное усиление гидролиза.
Ответг гидроксид алюминия.
Упражнение 2
1. Приведите по три примера солей для каждой из их групп по отношению к гидролизу.
2. Напишите уравнение гидролиза сульфида калия. Какой будет среда его раствора?
3. Назовите два любых иона, одновременное нахождение которых в растворе приведёт к взаимному усилению гидролиза.
Гидролиз органических соединений
Как было указано выше, реакция гидролиза может протекать как для неорганических, так и для органических веществ. В обоих случаях будет наблюдаться разложение вещества водой, однако органические вещества, как правило, гидролизуются только в кислой или в щелочной среде. В последнем случае реакция по факту протекает не с водой, а собственно с щёлочью, но в водном растворе.
Наиболее распространённый случай — гидролиз сложноэфирной группы. Таким образом могут разлагаться водой в кислой среде сложные эфиры, образуя спирт и карбоновую кислоту:
.
Если в неорганической химии гидролиз являлся реакцией, обратной нейтрализации, то в данном случае реакция будет обратна этерификации.
Аналогичным образом с водой взаимодействуют все классы веществ, содержащие сложноэфирную группу, в том числе жиры.
Жиры, имея большие неполярные углеводородные радикалы в составе молекулы, гидролизуются медленнее, чем сложные эфиры, поэтому их гидролиз обычно проводят в щелочной среде, получая при этом глицерин и соли высших жирных кислот. Поскольку такие соли называют мылами (в частности стеараты являются основными компонентами мыла), сама реакция гидролиза жиров получила название омыление.
Наряду с жирами гидролизуются и углеводы, кроме моносахаридов.
Достаточно хорошо в кислой среде эта реакция проходит для дисахаридов. Так, например, сахароза образует глюкозу и фруктозу. Полисахариды гидролизуются медленнее, для них эта реакция, как правило, требует нагревания или участия ферментов.
Аналогично участия ферментов требует и гидролиз пептидов. В нашем желудке белки подвергаются гидролизу при участии таких ферментов, как пепсин, трипсин и химотрипсин.
Эти реакции играют важнейшую роль в метаболизме, обеспечивая организм ресурсами для пластического и энергетического обмена.
Упражнение 3
1. Перечислите органические вещества, подверженные реакции гидролиза.
2. Что называют омылением жиров и почему?
3. Какие ферменты осуществляют гидролиз пептидов в организме человека?
Контрольные вопросы
1. Перечислите известные вам классы органических и неорганических соединений, для которых возможен гидролиз.
2. Как определить, какой будет среда раствора соли?
3. В каких случаях возможно взаимное усиление гидролиза?
Ответы
Упражнение 1
1. Обменная реакция с водой, приводящая к полному или частичному разложению вещества.
2. Гидролиз протекает обратимо и ступенчато.
Упражнение 2
2. , среда щелочная.
Упражнение 3
1. Сложные эфиры, жиры, ди- и полисахариды.
2. Щелочной гидролиз жиров. В этой реакции образуются мыла.
3. Пепин, трипсин, химотрипсин.
- Определение реакции гидролиза
- Гидролиз солей. Взаимное усиление гидролиза
- Гидролиз органических веществ
- знать, что такое гидролиз
- уметь определять поведение солей при гидролизе
- уметь записывать уравнения реакций гидролиза
Было бы довольно наивно полагать, что воду, которая в химии так часто используется для приготовления растворов, можно считать химически инертным соединением. Мы уже знаем, что вода обладает довольно большим количеством химических свойств. Среди них — способность реагировать с солями, вступая в реакцию гидролиза.
Помимо гидролиза солей, возможен также и гидролиз других соединений, в том числе и органических: сложных эфиров, жиров, ди- и полисахаридов, пептидов
и т. д.
Реакция гидролиза
Гидролиз — обменная реакция с водой, приводящая к полному или частичному разложению вещества.
По сути реакция гидролиза солей является обратным процессом реакции нейтрализации.
Гидролиз солей протекает обратимо и ступенчато.
Например, реакция гидролиза хлорида цинка — процесс, обратный реакции нейтрализации между гидроксидом цинка и соляной кислоты.
Так, для этой реакции
.
А в ионном виде —
.
Видно, что и в левой и в правой части присутствует слабый электролит, следовательно, протекание реакции возможно как в прямом, так и в обратном направлении.
Пример 1
Выбрать реакцию гидролиза:
- ,
- ,
- .
Решение
Давайте рассмотрим каждое уравнение внимательно.
1. Это реакция с водой, но в данном случае это соединение, а не обмен, поэтому это НЕ гидролиз.
2. Это обмен, но в данном случае вода — продукт этой реакции, следовательно, НЕ гидролиз.
3. Это реакция обмена и в ней участвует вода. Это гидролиз.
Ответ: реакция гидролиза под номером 3.
Обратите внимание, не все соли подвергаются гидролизу.
Упражнение 1
1. Какие реакции называют реакциями гидролиза?
2. Что характерно для реакций гидролиза?
3. Назовите пять любых органических веществ, вступающих в реакцию гидролиза.
Гидролиз солей
В зависимости от того, какими кислотами и основаниями образованы соли, их отношение к гидролизу может быть различным.
В зависимости от поведения солей в воде, их делят на 4 группы, представленные далее.
 Таблица 1. Гидролиз солей
Таблица 1. Гидролиз солей
Нерастворимые соли не подвергаются гидролизу.
При гидролизе солей могут образовываться кислые и средние соли.
В ионном виде становится наглядной причина изменения среды растворов при гидролизе солей.
При гидролизе по аниону, напротив, образуются гидроксид-ионы, чем и обусловлена щелочная среда.
Пример 2
Определите среду раствора хлорида алюминия и запишите уравнение реакции его гидролиза.
Решение
1. Хлорид алюминия образован сильной (HCl) кислотой и слабым (Al(OH)3) основанием, следовательно, реакция протекает по катиону, среда кислая.
2. Запишем сначала ионное уравнение, только по первой ступени, так как остальными принято пренебрегать.
Как можно видеть, мы должны получить основную соль. Теперь запишем и в молекулярном виде, подставив хлор:
.
Ответ: среда кислая.
В некоторых случаях, когда гидролиз идёт и по катиону, и по аниону, возможно взаимное усиление гидролиза.
Например, как при попадании в раствор сульфида хрома III, так и при смешивании растворов сульфидов и хрома III, будут параллельно происходить следующие процессы:
,
.
В результате этих процессов образуется вода , что способствует протеканию второй и третей ступени гидролиза.
Образование газообразного сероводорода и осадка гидроксида хрома III в результате реакции приводит к тому, что она протекает необратимо. В молекулярном виде получаем:
.
Определить, что происходит взаимное усиление гидролиза, можно по таблице растворимости. У таких солей будет стоять прочерк.
Пример 3
Определите, какой осадок образуется при взаимодействии карбоната калия и нитрата алюминия.
Решение
По таблице растворимости видим, что карбонат алюминия разлагается водой, следовательно, в данном случае происходит взаимное усиление гидролиза.
Ответг гидроксид алюминия.
Упражнение 2
1. Приведите по три примера солей для каждой из их групп по отношению к гидролизу.
2. Напишите уравнение гидролиза сульфида калия. Какой будет среда его раствора?
3. Назовите два любых иона, одновременное нахождение которых в растворе приведёт к взаимному усилению гидролиза.
Гидролиз органических соединений
Как было указано выше, реакция гидролиза может протекать как для неорганических, так и для органических веществ. В обоих случаях будет наблюдаться разложение вещества водой, однако органические вещества, как правило, гидролизуются только в кислой или в щелочной среде. В последнем случае реакция по факту протекает не с водой, а собственно с щёлочью, но в водном растворе.
Наиболее распространённый случай — гидролиз сложноэфирной группы. Таким образом могут разлагаться водой в кислой среде сложные эфиры, образуя спирт и карбоновую кислоту:
.
Если в неорганической химии гидролиз являлся реакцией, обратной нейтрализации, то в данном случае реакция будет обратна этерификации.
Аналогичным образом с водой взаимодействуют все классы веществ, содержащие сложноэфирную группу, в том числе жиры.
Жиры, имея большие неполярные углеводородные радикалы в составе молекулы, гидролизуются медленнее, чем сложные эфиры, поэтому их гидролиз обычно проводят в щелочной среде, получая при этом глицерин и соли высших жирных кислот. Поскольку такие соли называют мылами (в частности стеараты являются основными компонентами мыла), сама реакция гидролиза жиров получила название омыление.
Наряду с жирами гидролизуются и углеводы, кроме моносахаридов.
Достаточно хорошо в кислой среде эта реакция проходит для дисахаридов. Так, например, сахароза образует глюкозу и фруктозу. Полисахариды гидролизуются медленнее, для них эта реакция, как правило, требует нагревания или участия ферментов.
Аналогично участия ферментов требует и гидролиз пептидов. В нашем желудке белки подвергаются гидролизу при участии таких ферментов, как пепсин, трипсин и химотрипсин.
Эти реакции играют важнейшую роль в метаболизме, обеспечивая организм ресурсами для пластического и энергетического обмена.
Упражнение 3
1. Перечислите органические вещества, подверженные реакции гидролиза.
2. Что называют омылением жиров и почему?
3. Какие ферменты осуществляют гидролиз пептидов в организме человека?
Контрольные вопросы
1. Перечислите известные вам классы органических и неорганических соединений, для которых возможен гидролиз.
2. Как определить, какой будет среда раствора соли?
3. В каких случаях возможно взаимное усиление гидролиза?
Ответы
Упражнение 1
1. Обменная реакция с водой, приводящая к полному или частичному разложению вещества.
2. Гидролиз протекает обратимо и ступенчато.
Упражнение 2
2. , среда щелочная.
Упражнение 3
1. Сложные эфиры, жиры, ди- и полисахариды.
2. Щелочной гидролиз жиров. В этой реакции образуются мыла.
3. Пепин, трипсин, химотрипсин.

