- Качественные реакции на предельные углеводороды
- Качественные реакции на непредельные углеводороды
- Качественные реакции на карбоновые кислоты
- Качественные реакции на спирты
- Качественные реакции на альдегиды
- сформировать представление о качественных реакциях
- рассмотреть способы определения углеводородов
- научиться применять качественные реакции
Вы уже знаете, что химия изучает не только свойства веществ, но и их превращения, а также их свойства. Некоторые реакции как нельзя лучше отображают это понятие. Ещё на уроках биологии вы познакомились с такими реакциями. Например, чтобы определить наличие крахмала в картофеле, достаточно капнуть на него раствором йода, в результате чего появляется синее окрашивание.
В химии тоже пользуются такими признаками. Так, в курсе неорганической химии вы уже знакомились с некоторыми качественными реакциями.
Например, как вы знаете, ион серебра помогает различить галогеноводороды. Так с хлором образуется хлорид серебра — осадок белого цвета, а с бромом — бромид серебра — осадок, который окрашивается в светло-жёлтый цвет. Или же качественную реакцию на ион железа дают роданид-ионы, в результате взаимодействия их образуется ярко-красный раствор, который носит название красной кровяной соли.
Эти реакции можно перечислять до бесконечности, но сейчас время изучить качественные реакции, которые позволяют нам различать классы органических соединений.
Качественные реакции
В химии существуют определённые типы химических реакций: соединения, разложения, замещения, обмена, окислительно-восстановительные. Вы с ними давно знакомы и умеете работать. Качественная реакция представляет собой один из предложенных типов в зависимости от определяемого вещества.
Качественными называются реакции, которые сопровождаются видимыми изменениями (выпадение или растворение осадка, изменение цвета, выделение газа), что позволяет отнести органическое соединение к конкретному классу: алканы, алкины, арены и т. д.
Существует такое понятие, как качественный анализ, который способствует обнаружению элементов, входящих в состав вещества. При его применении в комплексе используются физико-химические, химические и физические методы, которые включают легко выполнимые опыты, основанные на взаимодействии определённых ионов, что дают образование/растворение осадка, выделение газа или изменение цвета.
Так, например, для того, чтобы повести качественную реакцию в водном растворе, необходимо учитывать, что протекает реакция ионного обмена, в результате которого можно обнаружить определённый катион или анион.
Качественные реакции на алканы
В этих реакциях исходные вещества — алканы, которые находятся в газообразном или жидком состоянии.
Предельные углеводороды с одинарной С–С связью, позволяющей присоединить максимальное число атомов углерода, называются алканами.
Для определения газообразных алканов используют реакцию горения. Газ поджигают и в результате наблюдают пламя синего цвета. Пламя синего цвета — характерный признак, который присущ только алканам. Таким образом, реакция горения является качественной реакцией на алканы, признаком которой будет пламя синего цвета.
Также для определения алканов используют раствор перманганата калия. Здесь обязательное условие реакции — отрицательная температура, так как в присутствии холода алканы не будут окисляться марганцовкой, а цвет раствора не изменится.
Качественные реакции на алкены
Перманганат калия является универсальным и сильным окислителем, что позволяет использовать его и в реакциях с алкенами.
Непредельные нециклические углеводороды с одной двойной С–С связью, при которой атомы углерода обладают sp2- гибридизацией, называются алкенами.
Так, при пропускании алкена через раствор марганцовки происходит реакция окисления, которая носит название реакция Вагнера. При взаимодействии перманганата и алкена наблюдается обесцвечивание малинового раствора и образование бурого осадка — оксида марганца (IV).
Рассмотрим данную реакцию.
Пример 1
Написать реакцию взаимодействия между этиленом и перманганатом калия.
Решение
1. Записать реакцию между этиленом и перманганатом калия.
2. Запишем окислительно-восстановительный процесс этой реакции.
1 3 восстановитель
3
3 1 окислитель
3. Расставить коэффициенты.
В ходе химической реакции этилен окисляется до этиленгликоля и выпадает осадок бурого цвета, в результате чего раствор обесцвечивается.
Аналогично можно рассмотреть ещё одну качественную реакцию на алкены. Реакция также является окислительно-восстановительной, но в качестве восстановителя, например с пропеном, уже выступает бром.
В результате реакции образуется 1,2-дибромпропан, а раствор обесцвечивается, аналогично реакции с перманганатом калия.
Качественные реакции на алкины
Любой непредельный углеводород можно определить с помощью реакции окисления.
Непредельные нециклические углеводороды с одной тройной С–С связью, при которой атомы углерода обладают sp- гибридизацией, называются алкинами.
Также и алкины обнаруживаются в результате реакции Вагнера, с образованием осадка бурого цвета и обесцвечивания раствора:
.
В процессе окисления образуется из алкена, в данном случае этина, калиевая
соль — этандиат калия.
Если же мы рассматриваем реакцию с бромной водой, то характерным признаком также будет обесцвечивание раствора:
.
В ходе реакции пропин окисляется до 1,2-тетрабромпропена, а раствор бромной воды обесцвечивается.
Также, если алкин обладает тройной связью у крайнего атома, а не в середине, то можно использовать аммиачный раствор оксида серебра, который носит название реактив Толленса:
.
В ходе реакции образуется ацетиленид серебра (I), который выпадает в качестве осадка белого цвета.
Контрольные вопросы
1. Что заключается в понятии «качественная реакция»?
2. В чём отличие между качественными реакциями на алкены и алкины?
3. Почему с помощью аммиачного раствора оксида серебра нельзя определить пропин-2?
Качественные реакции на карбоновые кислоты
Карбоновые кислоты отличаются от непредельных углеводородов наличием двух кислородов, которые входят в состав карбоксильной группы, что является основной характеристикой данного класса веществ.
Органические соединения, в составе которых присутствует функциональная группа называются карбоновыми кислотами.
Как раз присутствие карбоксильной группы и обуславливает качественные реакции. Таким образом, чтобы найти карбоновую кислоту, необходимо применить карбоновую соль щелочного металла, например
Давайте рассмотрим реакцию взаимодействия карбоната калия и щавелевой кислоты.
Пример 2
Написать реакцию образования оксолата калия.
Решение
1. Запишем реакцию между карбонатом и щавелевой кислотой:
.
2. Протекает реакция обмена, в результате которой выделяется большое количество углекислого газа и идёт активное «шипение».
3. Расставляем коэффициенты:
.
Качественные реакции на спирты
Спирты — это те же кислоты, но более слабые, даже слабее, чем вода. Соответственно качественные реакции на спирты могут произойти или с активными металлами, или с сильным окислителем.
Органические соединения, в составе которых присутствует одна или несколько функциональных групп называются спиртами.
Самой яркой качественной реакцией на спирты является взаимодействие их с дихроматом калия в присутствии раствора серной кислоты.

В результате образуется кислота из первичного спирта, а вторичные окисляются до кетонов. Но здесь есть свои особенности: данная реакция является актуальной только для первичных и вторичных спиртов. Причина этого кроется в том, что они легче поддаются окислению, чем третичные. Реакция сопровождается ярким переходом цветов: из ярко-оранжевого раствор становится голубовато-зелёным.
Также определяющими спирты являются металлический калий или натрий. В результате взаимодействия спиртов с ними происходит замещение водорода на активный металл:
.
При данном взаимодействии видимый признак реакции — выделение водорода, наличие которого можно проверить внесением тлеющей лучины и характерному звуку «ПА» при сгорании водорода. Также при добавлении фенолфталеина раствор окрасится в фиолетовый цвет.
Многоатомные спирты опять же этой реакцией не определяются, поэтому для них выявлена специальная реакция. При взаимодействии трёхатомного спирта, например глицерина, с гидроксидом меди (II) образуется осадок ярко-синего цвета, характерный для большинства солей меди.
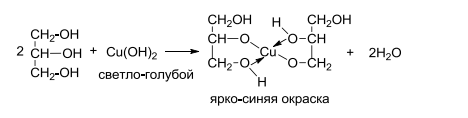
Качественные реакции на альдегиды
Для альдегидов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны. Также все реакции на альдегиды характерны и для некоторых углеводов, например глюкозы, которая имеет альдегидную группу.
1. Реакция серебряного зеркала
Самой красивой реакцией на альдегиды является взаимодействие с аммиачным раствором оксида серебра при нагревании:
.
Основной признак реакции серебряного зеркала заключается в образовании металлического серебра на стенках стеклянного сосуда (рис. 1).
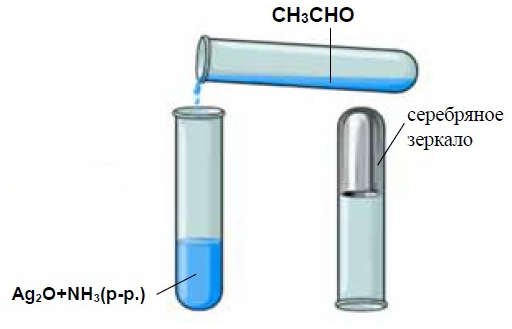 Рисунок 1. Реакция серебряного зеркала
Рисунок 1. Реакция серебряного зеркала
Но у этой реакции есть одна особенность, которая проявляется при участии метановой (муравьиной) кислоты . Причина этой особенности заключается в том, что муравьиная кислота — единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы.
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду, при этом также образуется осадок серебра.
(реакция идет при нагревании)
2. Реакция медного зеркала
Это взаимодействие очень похоже на вышеуказанную реакцию. Особенно важно, чтобы для реакции использовали свежеприготовленный раствор гидроксида меди.
Для проведения реакции к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
.
В результате на стенках сосуда образуется медный налёт или выпадает оксид меди (I) — осадок красного цвета (рис. 2).
 Рисунок 2. Реакция медного зеркала
Рисунок 2. Реакция медного зеркала
Контрольные вопросы
1. Почему карбоновые кислоты имеют более высокую кислотность относительно спиртов?
2. Можно ли определить глицерин с помощью бихромата аммония?
3. Почему как качественную реакцию на щавелевую кислоту можно использовать серную кислоту?

