- Периодический закон и периодическая система Д. И. Менделеева
- Строение электронной оболочки
- Электронная конфигурация атома
- знать понятия: периодическая система, валентные электроны, корпускулярно-волновая природа электрона, орбиталь, энергетический уровень, внешний энергетический уровень, завершённый энергетический уровень, s, p, d, f-орбитали, проскок электронов, проскок электронов, электронные семейства периодической системы
- уметь определять свойства химического элемента в зависимости от его положения в ПС, составлять электронную конфигурацию атома
Вступление
 Рис. 1. Самая большая в Евразии периодическая таблица Менделеева
Рис. 1. Самая большая в Евразии периодическая таблица Менделеева
23 июля 2021 г. в подмосковной Дубне открыли самую большую в Европе таблицу Менделеева. Таблица состоит из 121 клеточки. Сейчас в таблице Менделеева находится 118 химических элементов. Ещё три клеточки в таблице химических элементов оставили пустыми — 119, 120, 121.
Периодический закон и периодическая система Д. И. Менделеева
 Рис. 2. Полудлинный вариант ПС
Рис. 2. Полудлинный вариант ПС
ПС химических элементов Д. И. Менделеева — это графическое выражение периодического закона. Символика, принятая в ПС, несёт в себе информацию:
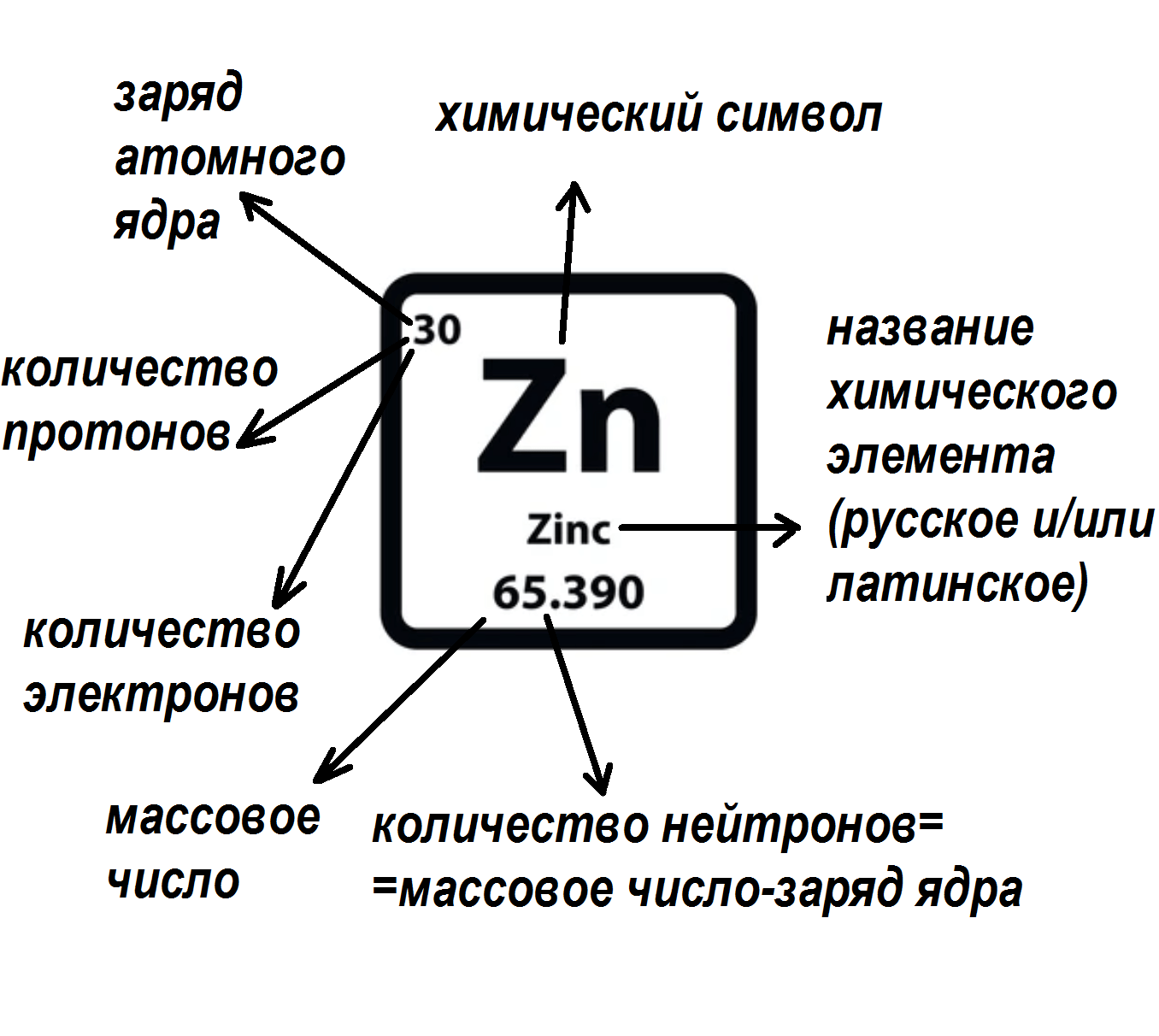 Схема 1. Характеристика элемента
Схема 1. Характеристика элемента
- заряд ядра, который определяется числом протонов, соответствует порядковому номеру элемента;
- число электронов соответствует порядковому номеру элемента;
- число нейтронов определяется по разности между массовым числом изотопа и порядковым номером элемента.
В образовании химических связей принимают участие электроны внешнего и предвнешнего электронных слоёв. Такие электроны называются валентными.
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от строения внешних и предвнешних электронных слоёв их атомов.
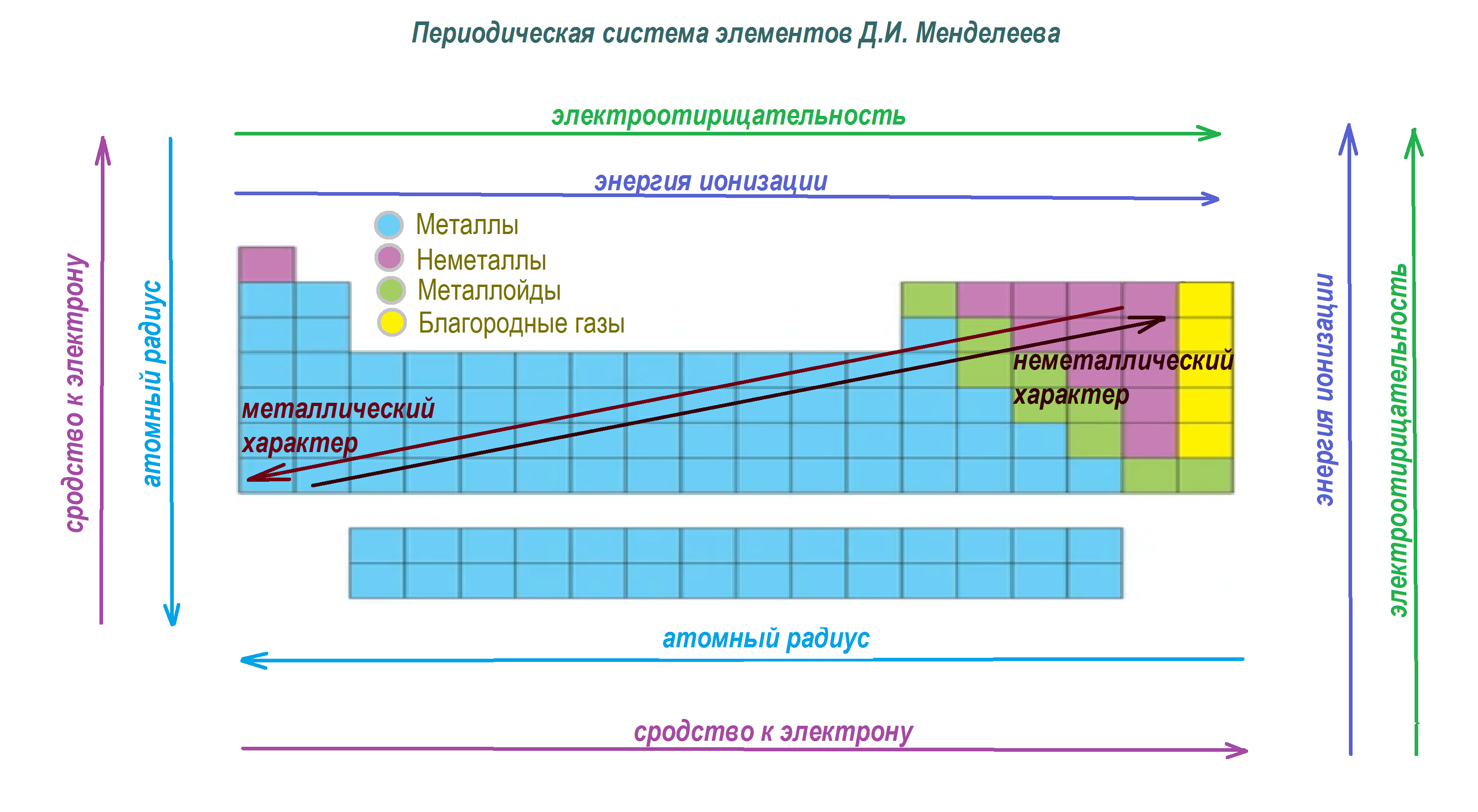 Рис. 3. Закономерности изменения свойств элементов главных подгрупп, их соединений и простых веществ по периодам и группам
Рис. 3. Закономерности изменения свойств элементов главных подгрупп, их соединений и простых веществ по периодам и группам
Пример 1
Среди перечисленных элементов наименьшей электроотрицательностью обладает:
1) сера, 2) кислород, 3) углерод, 4) кремний.
Решение
Углерод и кремний обладают меньшей электроотрицательностью, чем сера и кислород, если находятся в одном и том же периоде. Для элементов одной и той же группы наименьшей электроотрицательностью обладает элемент с наибольшим атомным номером, в нашем случае — кремний.
Ответ: 4.
Упражнение 1
Дан перечень элементов:
Выберите три элемента, которые в ПС находятся в одной группе, и расположите эти элементы в порядке увеличения энергии ионизации.
Строение электронной оболочки
Химические свойства элементов определяются строением электронной оболочки атома. Число электронов в атоме равно заряду ядра и порядковому номеру элемента.
Электрон — частица, имеющая очень маленькую массу. Именно поэтому электрон обладает особыми свойствами, непохожими на свойства окружающих нас объектов макромира. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя как частица и как волна.
Для электрона невозможно одновременно точно определить место положения и скорость. Движение электронов в атоме описывают с помощью квантовой механики, которая вводит понятие орбиталей. Каждый электрон в атоме находится на своей орбитали.
Орбиталь — это часть электронного облака, создаваемого электронами при движении в атоме. Орбиталь характеризует область пространства, где чаще всего находится электрон.
На каждой орбитали может находиться не более двух электронов.
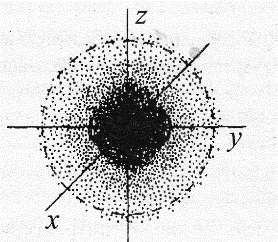 Рис. 4. Электронное облако атома водорода
Рис. 4. Электронное облако атома водорода
Чтобы лучше представить себе орбиталь, необходимо за доли секунды сделать несколько снимков, то есть сфотографировать положение электрона в атоме. И в результате при наложении друг на друга бесчисленного множества таких фотографий формируется картинка электронного облака (рис. 4).
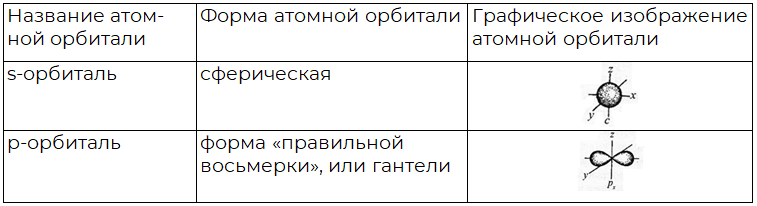 Таблица 1. Формы атомных орбиталей
Таблица 1. Формы атомных орбиталей
Электроны, обладающие близкими значениями энергии, образуют единый энергетический уровень.
Особенности строения энергетических уровней:
- число энергетических уровней равно номеру периода;
- энергетические уровни нумеруют, начиная от ядра.
- наиболее удалённый от ядра энергетический уровень называют внешним;
- наименьшей энергией обладают электроны первого энергетического уровня;
- максимальное число электронов на энергетическом уровне определяется по формуле: , где — максимальное число электронов на энергетическом уровне, n — номер периода;
В соответствии с формулой:
- на 1-м энергетическом уровне может находится максимум 2 электрона;
- на 2-м — максимум 8 электронов;
- на 3-м — максимум 18 электронов;
- на 4-м — максимум 32 электрона;
- в настоящее время веществ, для которых N = 5, не существует.
- eсли на энергетическом уровне содержится максимальное число электронов, которое он может вместить, то он называется завершённым — такие уровни отличаются большой прочностью и устойчивостью;
- начиная со второго периода (N = 2), энергетические уровни делятся на подуровни, которые незначительно отличаются друг от друга по энергии;
- число подуровней равно N: различают s-, р-, d-, f-подуровни;
- подуровни состоят из атомных орбиталей — условно атомную орбиталь обозначают клеточкой.
Условно электрон обозначают стрелкой: ↑. Два электрона рисуют разнонаправленными: ↑↓.
На каждой орбитали может находиться один электрон (тогда его называют неспаренным электроном) или два электрона (электронная пара или спаренные электроны); кроме того, орбиталь может быть пустой (свободной, или вакантной).
При графическом изображении строения энергетических уровней:
s-орбитали соответствует одна клеточка;
р-орбитали соответствуют три клеточки;
d-орбитали соответствуют пять клеточек;
f-орбитали соответствуют семь клеточек.
Число электронов на внешнем энергетическом уровне равно номеру группы (для элементов главных подгрупп); двум (для большинства элементов побочных подгрупп).
Исключение:
- элементы первой группы побочной подгруппы на внешнем уровне содержат только 1 электрон.
- на внешнем уровне содержат только 1 электрон. Это объясняется «проскоком» электрона.
- не имеет электронов на внешней d-оболочке.
Пример 2
№ 1. Укажите верное суждение:
А) на одной орбитали может быть не более 2 электронов;
Б) на одном уровне не может быть более трёх d-орбиталей.
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
№2. Установите соответствие между номером энергетического уровня и максимальным числом электронов, которые могут располагаться на этом уровне. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
УРОВЕНЬ | ЧИСЛО ЭЛЕКТРОНОВ | ||
А) | 1 | 1) | 2 |
Б) | 2 | 2) | 4 |
В) | 3 | 3) | 8 |
Г) | 4 | 4) | 9 |
5) | 18 | ||
6) | 32 | ||
Решение
№ 1 — 1
№ 2 — 1, 3, 5, 6
Упражнение 2
A1. Число электронов в атоме фтора F
1) 19 2) 10 3) 9 4) 28
А2. Число нейтронов в атоме алюминия
1) 14 2) 13 3) 27 4) 40
А3. Массовое число изотопа хлора, атом которого содержит 20 нейтронов
1) 35 2) 37 3) 20 4) 17
А4. Заряд атома магния, содержащего 10 электронов
1) + 12 2) + 3 3) + 2 4) + 1
А5. Сферическая форма электронного облака соответствует
1) f-электрону 3) р-электрону
2) d-электрону 4) s-электрону
A6. Гантелеобразная форма электронного облака соответствует
1) s-электрону 3) d-электрону
2) р-электрону 4) f-электрону
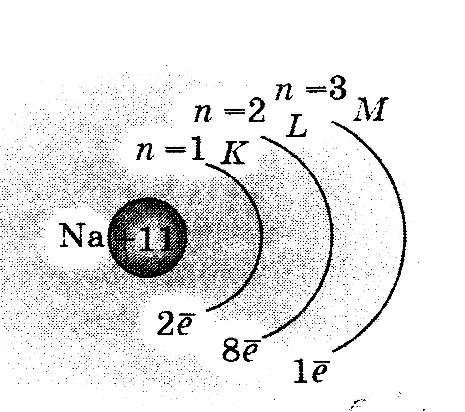 Рис. 5. Упрощённое строение атома натрия
Рис. 5. Упрощённое строение атома натрия
Электронная конфигурация атома
Распределение электронов в атоме называют электронной конфигурацией.
Её можно записывать двумя способами:
1) упрощённо, показывая только общее число электронов на каждом энергетическом уровне. Строение атома натрия представлено на рис. 5;
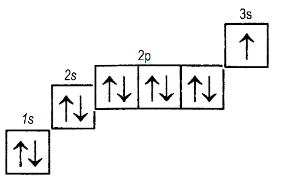 Рис. 6. Электронно-графическая формула натрия
Рис. 6. Электронно-графическая формула натрия
2) подробно, характеризуя число электронов на каждой занятой орбитали. Строение атома натрия: электронная формула электронно-графическая на рис. 6.
Распределение электронов по энергетическим уровням и подуровням подчиняется ряду правил.
Наиболее устойчивое состояние электрона в атоме соответствует минимальному значению его энергии. Любое другое состояние называется возбуждённым.
Распределение электронов по энергетическим уровням и подуровням должно осуществляться согласно ряду: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d...
Сначала все орбитали подуровня заполняются одним электроном (с одинаковым спином), а затем вторым электроном (с противоположным спином).
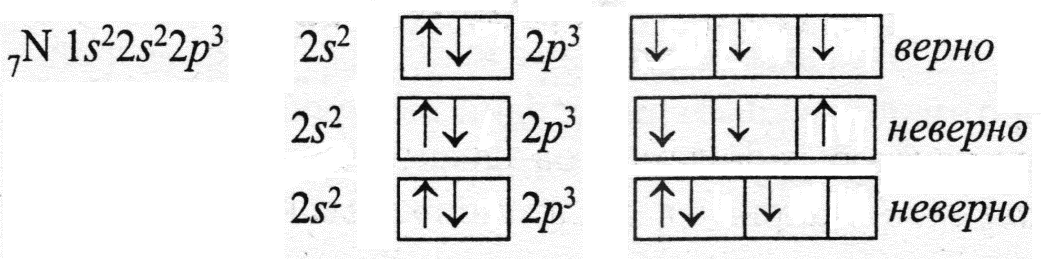
На одной орбитали может находиться не более 2 электронов, имеющих противоположные спины. Поэтому при графическом изображении в одной клеточке рисуем не более 2 противоположно направленных стрелочек.
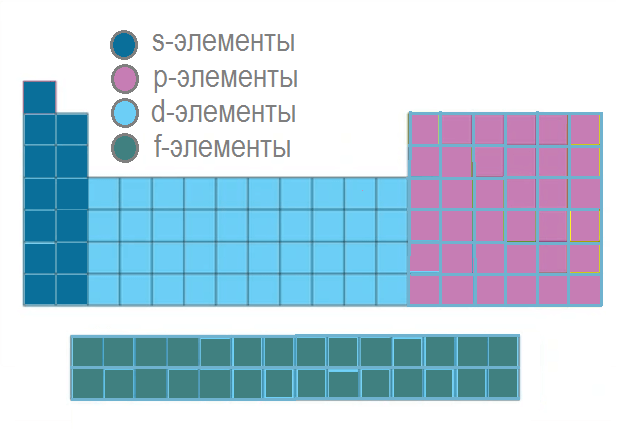 Рис. 7. Электронные семейства ПС
Рис. 7. Электронные семейства ПС
В зависимости от того, какой подуровень заполняется электронами, все элементы делятся на 4 группы:
- s-элементы: заполняется s-подуровень;
- р-элементы: заполняется p-подуровень;
- d-элементы: заполняется d-подуровень;
- f-элементы: заполняется f-подуровень.
Особенность d-элементов в том, что при переходе к каждому последующему d-элементу электрон появляется не на внешнем, а на втором снаружи подуровне. Внешний уровень у них, как правило, содержит 2 электрона. Для некоторых d-элементов характерен «проскок» (провал) электронов. Например, для атомов хрома и меди.
«Проскок» электронов объясняется тем, что для атома энергетически более выгодно состояние, когда р-, d-, f- подуровни не заполнены, заполнены наполовину (неспаренными электронами), заполнены полностью. Поэтому для элементов побочных подгрупп характерно увеличение окислительных свойств с ростом величины заряда ядра.
Пример 3
Распределение электронов по энергетическим уровням атома имеет такой вид.
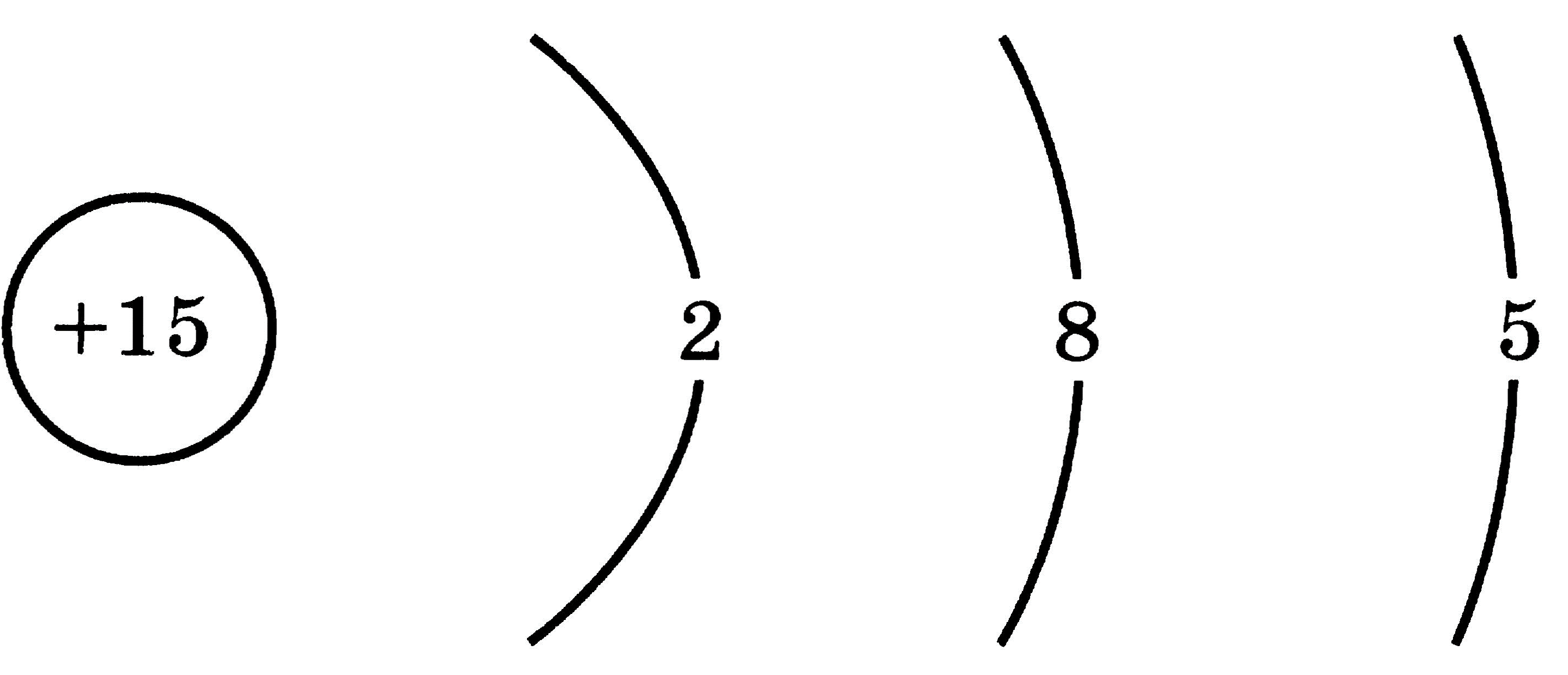
Сколько электронов не хватает атому до конфигурации инертного газа?
Решение
На внешнем уровне содержится 5 электронов. Ближайший инертный газ (аргон) имеет порядковый номер 18 и электронную конфигурацию 2 8 8. На внешнем уровне у аргона — 8 электронов, поэтому данному элементу до конфигурации аргона не хватает 8 − 5 = 3 электрона.
Ответ: 3.
Пример 4
На внешнем энергетическом уровне элемента 2-го периода в два раза больше электронов, чем на внутреннем уровне. Этот элемент:
1) литий, 3) углерод,
2) бериллий, 4) кислород.
Решение
У элементов 2-го периода внутренний уровень — один, первый, на нём находится всего два электрона. Следовательно, на внешнем уровне — 4 электрона. Упрощённая электронная конфигурация атома: 2 4. Всего в атоме 6 электронов, порядковый номер элемента равен 6, это — углерод.
Ответ: 3.
Упражнение 3
Сколько р-электронов имеется на внешнем энергетическом уровне в основном состоянии атома с зарядом ядра +15?
Упражнение 4
Напишите электронную конфигурацию атома хлора. Сколько энергетических уровней заполнено электронами в этом атоме? Сколько валентных электронов имеет атом хлора в основном состоянии?
Контрольные вопросы
1. Что такое электронная оболочка атома?
2. Каков характер движения электрона в атоме?
3. Что называется атомной орбиталью?
4. Что такое электронное облако?
5. Что такое энергетический уровень?
6. Что такое электронный слой?
Ответы
Упражнение 1
Ответ: 451.
Упражнение 2
А1 — 3; А2 — 1; А3 — 2; А4 — 3; А5 — 4; А6 — 2.
Упражнение 3
Ответ: 3.
Упражнение 4
Ответ: три энергетических уровня, 7 валентных электронов.
- Периодический закон и периодическая система Д. И. Менделеева
- Строение электронной оболочки
- Электронная конфигурация атома
- знать понятия: периодическая система, валентные электроны, корпускулярно-волновая природа электрона, орбиталь, энергетический уровень, внешний энергетический уровень, завершённый энергетический уровень, s, p, d, f-орбитали, проскок электронов, проскок электронов, электронные семейства периодической системы
- уметь определять свойства химического элемента в зависимости от его положения в ПС, составлять электронную конфигурацию атома
Вступление
 Рис. 1. Самая большая в Евразии периодическая таблица Менделеева
Рис. 1. Самая большая в Евразии периодическая таблица Менделеева
23 июля 2021 г. в подмосковной Дубне открыли самую большую в Европе таблицу Менделеева. Таблица состоит из 121 клеточки. Сейчас в таблице Менделеева находится 118 химических элементов. Ещё три клеточки в таблице химических элементов оставили пустыми — 119, 120, 121.
Периодический закон и периодическая система Д. И. Менделеева
 Рис. 2. Полудлинный вариант ПС
Рис. 2. Полудлинный вариант ПС
ПС химических элементов Д. И. Менделеева — это графическое выражение периодического закона. Символика, принятая в ПС, несёт в себе информацию:
 Схема 1. Характеристика элемента
Схема 1. Характеристика элемента
- заряд ядра, который определяется числом протонов, соответствует порядковому номеру элемента;
- число электронов соответствует порядковому номеру элемента;
- число нейтронов определяется по разности между массовым числом изотопа и порядковым номером элемента.
В образовании химических связей принимают участие электроны внешнего и предвнешнего электронных слоёв. Такие электроны называются валентными.
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от строения внешних и предвнешних электронных слоёв их атомов.
 Рис. 3. Закономерности изменения свойств элементов главных подгрупп, их соединений и простых веществ по периодам и группам
Рис. 3. Закономерности изменения свойств элементов главных подгрупп, их соединений и простых веществ по периодам и группам
Пример 1
Среди перечисленных элементов наименьшей электроотрицательностью обладает:
1) сера, 2) кислород, 3) углерод, 4) кремний.
Решение
Углерод и кремний обладают меньшей электроотрицательностью, чем сера и кислород, если находятся в одном и том же периоде. Для элементов одной и той же группы наименьшей электроотрицательностью обладает элемент с наибольшим атомным номером, в нашем случае — кремний.
Ответ: 4.
Упражнение 1
Дан перечень элементов:
Выберите три элемента, которые в ПС находятся в одной группе, и расположите эти элементы в порядке увеличения энергии ионизации.
Строение электронной оболочки
Химические свойства элементов определяются строением электронной оболочки атома. Число электронов в атоме равно заряду ядра и порядковому номеру элемента.
Электрон — частица, имеющая очень маленькую массу. Именно поэтому электрон обладает особыми свойствами, непохожими на свойства окружающих нас объектов макромира. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя как частица и как волна.
Для электрона невозможно одновременно точно определить место положения и скорость. Движение электронов в атоме описывают с помощью квантовой механики, которая вводит понятие орбиталей. Каждый электрон в атоме находится на своей орбитали.
Орбиталь — это часть электронного облака, создаваемого электронами при движении в атоме. Орбиталь характеризует область пространства, где чаще всего находится электрон.
На каждой орбитали может находиться не более двух электронов.
 Рис. 4. Электронное облако атома водорода
Рис. 4. Электронное облако атома водорода
Чтобы лучше представить себе орбиталь, необходимо за доли секунды сделать несколько снимков, то есть сфотографировать положение электрона в атоме. И в результате при наложении друг на друга бесчисленного множества таких фотографий формируется картинка электронного облака (рис. 4).
 Таблица 1. Формы атомных орбиталей
Таблица 1. Формы атомных орбиталей
Электроны, обладающие близкими значениями энергии, образуют единый энергетический уровень.
Особенности строения энергетических уровней:
- число энергетических уровней равно номеру периода;
- энергетические уровни нумеруют, начиная от ядра.
- наиболее удалённый от ядра энергетический уровень называют внешним;
- наименьшей энергией обладают электроны первого энергетического уровня;
- максимальное число электронов на энергетическом уровне определяется по формуле: , где — максимальное число электронов на энергетическом уровне, n — номер периода;
В соответствии с формулой:
- на 1-м энергетическом уровне может находится максимум 2 электрона;
- на 2-м — максимум 8 электронов;
- на 3-м — максимум 18 электронов;
- на 4-м — максимум 32 электрона;
- в настоящее время веществ, для которых N = 5, не существует.
- eсли на энергетическом уровне содержится максимальное число электронов, которое он может вместить, то он называется завершённым — такие уровни отличаются большой прочностью и устойчивостью;
- начиная со второго периода (N = 2), энергетические уровни делятся на подуровни, которые незначительно отличаются друг от друга по энергии;
- число подуровней равно N: различают s-, р-, d-, f-подуровни;
- подуровни состоят из атомных орбиталей — условно атомную орбиталь обозначают клеточкой.
Условно электрон обозначают стрелкой: ↑. Два электрона рисуют разнонаправленными: ↑↓.
На каждой орбитали может находиться один электрон (тогда его называют неспаренным электроном) или два электрона (электронная пара или спаренные электроны); кроме того, орбиталь может быть пустой (свободной, или вакантной).
При графическом изображении строения энергетических уровней:
s-орбитали соответствует одна клеточка;
р-орбитали соответствуют три клеточки;
d-орбитали соответствуют пять клеточек;
f-орбитали соответствуют семь клеточек.
Число электронов на внешнем энергетическом уровне равно номеру группы (для элементов главных подгрупп); двум (для большинства элементов побочных подгрупп).
Исключение:
- элементы первой группы побочной подгруппы на внешнем уровне содержат только 1 электрон.
- на внешнем уровне содержат только 1 электрон. Это объясняется «проскоком» электрона.
- не имеет электронов на внешней d-оболочке.
Пример 2
№ 1. Укажите верное суждение:
А) на одной орбитали может быть не более 2 электронов;
Б) на одном уровне не может быть более трёх d-орбиталей.
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
№2. Установите соответствие между номером энергетического уровня и максимальным числом электронов, которые могут располагаться на этом уровне. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
УРОВЕНЬ | ЧИСЛО ЭЛЕКТРОНОВ | ||
А) | 1 | 1) | 2 |
Б) | 2 | 2) | 4 |
В) | 3 | 3) | 8 |
Г) | 4 | 4) | 9 |
5) | 18 | ||
6) | 32 | ||
Решение
№ 1 — 1
№ 2 — 1, 3, 5, 6
Упражнение 2
A1. Число электронов в атоме фтора F
1) 19 2) 10 3) 9 4) 28
А2. Число нейтронов в атоме алюминия
1) 14 2) 13 3) 27 4) 40
А3. Массовое число изотопа хлора, атом которого содержит 20 нейтронов
1) 35 2) 37 3) 20 4) 17
А4. Заряд атома магния, содержащего 10 электронов
1) + 12 2) + 3 3) + 2 4) + 1
А5. Сферическая форма электронного облака соответствует
1) f-электрону 3) р-электрону
2) d-электрону 4) s-электрону
A6. Гантелеобразная форма электронного облака соответствует
1) s-электрону 3) d-электрону
2) р-электрону 4) f-электрону
 Рис. 5. Упрощённое строение атома натрия
Рис. 5. Упрощённое строение атома натрия
Электронная конфигурация атома
Распределение электронов в атоме называют электронной конфигурацией.
Её можно записывать двумя способами:
1) упрощённо, показывая только общее число электронов на каждом энергетическом уровне. Строение атома натрия представлено на рис. 5;
 Рис. 6. Электронно-графическая формула натрия
Рис. 6. Электронно-графическая формула натрия
2) подробно, характеризуя число электронов на каждой занятой орбитали. Строение атома натрия: электронная формула электронно-графическая на рис. 6.
Распределение электронов по энергетическим уровням и подуровням подчиняется ряду правил.
Наиболее устойчивое состояние электрона в атоме соответствует минимальному значению его энергии. Любое другое состояние называется возбуждённым.
Распределение электронов по энергетическим уровням и подуровням должно осуществляться согласно ряду: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d...
Сначала все орбитали подуровня заполняются одним электроном (с одинаковым спином), а затем вторым электроном (с противоположным спином).

На одной орбитали может находиться не более 2 электронов, имеющих противоположные спины. Поэтому при графическом изображении в одной клеточке рисуем не более 2 противоположно направленных стрелочек.

 Рис. 7. Электронные семейства ПС
Рис. 7. Электронные семейства ПС
В зависимости от того, какой подуровень заполняется электронами, все элементы делятся на 4 группы:
- s-элементы: заполняется s-подуровень;
- р-элементы: заполняется p-подуровень;
- d-элементы: заполняется d-подуровень;
- f-элементы: заполняется f-подуровень.
Особенность d-элементов в том, что при переходе к каждому последующему d-элементу электрон появляется не на внешнем, а на втором снаружи подуровне. Внешний уровень у них, как правило, содержит 2 электрона. Для некоторых d-элементов характерен «проскок» (провал) электронов. Например, для атомов хрома и меди.
«Проскок» электронов объясняется тем, что для атома энергетически более выгодно состояние, когда р-, d-, f- подуровни не заполнены, заполнены наполовину (неспаренными электронами), заполнены полностью. Поэтому для элементов побочных подгрупп характерно увеличение окислительных свойств с ростом величины заряда ядра.
Пример 3
Распределение электронов по энергетическим уровням атома имеет такой вид.

Сколько электронов не хватает атому до конфигурации инертного газа?
Решение
На внешнем уровне содержится 5 электронов. Ближайший инертный газ (аргон) имеет порядковый номер 18 и электронную конфигурацию 2 8 8. На внешнем уровне у аргона — 8 электронов, поэтому данному элементу до конфигурации аргона не хватает 8 − 5 = 3 электрона.
Ответ: 3.
Пример 4
На внешнем энергетическом уровне элемента 2-го периода в два раза больше электронов, чем на внутреннем уровне. Этот элемент:
1) литий, 3) углерод,
2) бериллий, 4) кислород.
Решение
У элементов 2-го периода внутренний уровень — один, первый, на нём находится всего два электрона. Следовательно, на внешнем уровне — 4 электрона. Упрощённая электронная конфигурация атома: 2 4. Всего в атоме 6 электронов, порядковый номер элемента равен 6, это — углерод.
Ответ: 3.
Упражнение 3
Сколько р-электронов имеется на внешнем энергетическом уровне в основном состоянии атома с зарядом ядра +15?
Упражнение 4
Напишите электронную конфигурацию атома хлора. Сколько энергетических уровней заполнено электронами в этом атоме? Сколько валентных электронов имеет атом хлора в основном состоянии?
Контрольные вопросы
1. Что такое электронная оболочка атома?
2. Каков характер движения электрона в атоме?
3. Что называется атомной орбиталью?
4. Что такое электронное облако?
5. Что такое энергетический уровень?
6. Что такое электронный слой?
Ответы
Упражнение 1
Ответ: 451.
Упражнение 2
А1 — 3; А2 — 1; А3 — 2; А4 — 3; А5 — 4; А6 — 2.
Упражнение 3
Ответ: 3.
Упражнение 4
Ответ: три энергетических уровня, 7 валентных электронов.



