- Атом
- Абсолютная масса атома
- Относительная атомная масса
- Нуклиды
- знать понятия: атом, электрон, протон, нейтрон и состав ядра, протонное, нейтронное и массовое число, атомная единица массы, относительная атомная масса, нуклиды, изотопы, изобары, изотоны, химический элемент
- уметь определять количество протонов, нейтронов и электронов, рассчитывать абсолютную атомную массу атомов, составлять формулу нуклида, рассчитать изотопный состав химического элемента
 Рис. 1. Демокрит
Рис. 1. Демокрит
Греческий философ Демокрит (460–370 г. до н. э.) был первым человеком, который догадался, что все вещества состоят из крошечных частичек, которые нельзя разделить на более мелкие. Он и назвал эти частички атомами, что по-гречески значит «неделимые».
 Рис. 2. Амедео Авогадро
Рис. 2. Амедео Авогадро
Итальянский физик и химик Амедео Авогадро
(1776–1856) доказал, что атомы объединяются в молекулы. Он также установил, что равные объёмы любых газов при одинаковых температуре и давлении содержат одинаковое количество молекул. На основании этого открытия (сегодня мы знаем его как закон Авогадро) он смог придумать метод определения атомной и молекулярной массы всех химических элементов.
Атом
Атом — электронейтральная частица, которая состоит из положительно заряженного ядра и отрицательно заряженных электронов. Атомы могут существовать как в свободном состоянии, так и связанными с атомами того же элемента или других элементов, образуя молекулы.
 Рис. 3. Изображение атомов кристалла празеодима
Рис. 3. Изображение атомов кристалла празеодима
Физики смогли «сфотографировать» отдельные атомы в рекордном разрешении. Искажения, которые можно увидеть на фотографии, обусловлены тепловыми колебаниями самих атомов. Используемая техника называется птихография. Исследователи планируют ещё больше улучшить изображение, охладив образец: это уменьшит дрожь атомов и приведёт к ещё более чёткой фотографии.
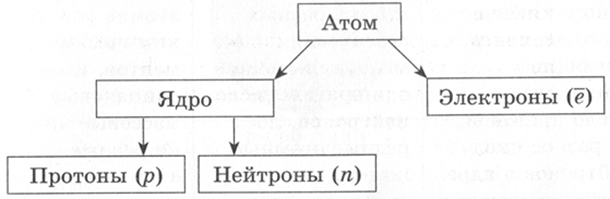 Схема 1. Строение атома
Схема 1. Строение атома
Протоны, нейтроны и электроны называются элементарными частицами.
|
Название
|
Обозначение
|
Масса
|
Заряд
|
|
Электрон
|
|
|
|
|
Протон
|
p
|
1
|
|
|
Нейтрон
|
n
|
1
|
0
|
Электрон — частица с отрицательным электрическим зарядом. Имеет свойства волны. Электроны, которые движутся вокруг ядер атомов, образуют электронные оболочки, определяющие электрические, оптические и химические свойства атомов и молекул. Важную роль играют валентные электроны, которые принимают участие в образовании химических связей, обычно это электроны внешнего слоя.
Протон — это частица, которая имеет положительный заряд. Заряд протона в условных единицах равен +1. Символ протона — 1р.
Нейтрон — нейтральная частица, заряд нейтрона равен 0. Символ нейтрона — 0n.
Состав атомного ядра описывается формулой:
.
Z — протонное число, показывает число протонов в ядре и их суммарную массу (относительную);
N — нейтронное число, показывает число нейтронов в ядре и их суммарную массу (относительную);
А — массовое (нуклонное) число — это сумма нейтронов и протонов в ядре и их суммарная масса (относительная).
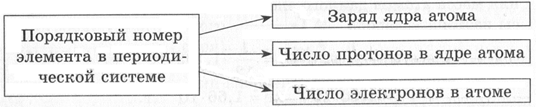 Схема 2. Порядковый номер
Схема 2. Порядковый номер
Пример 1
Сколько электронов, протонов и нейтронов имеет сера-32?
Решение
32
16S — масса атома записывается в левом верхнем углу относительно элемента, а порядковый номер — в левом нижнем углу.
e = 16 — количество электронов принимаем равным порядковому номеру элемента
p = 16 — количество электронов принимаем равным порядковому номеру элемента
n = 32 − 16 = 16 — количество нейтронов равно разности между массовым числом и количеством протонов
Пример 2
Сколько нейтронов содержит ядра атомов
Решение
N(n)Cl = A − Z = 37 − 17 = 20
N(n)O = A − Z = 18 − 8 = 10
N(n)Si = A − Z = 30 − 14 = 16
N(n)F = A − Z = 19 − 9 = 10
Упражнение 1
Заполните свободные клетки в следующей таблице (каждая строка в таблице соответствует одному атому).
|
Атом
|
Число протонов
|
Число электронов
|
Заряд ядра (Z)
|
Число нейтронов
|
Число нуклонов
|
|
№ 1
|
1
|
|
|
0
|
|
|
№ 2
|
|
6
|
|
|
12
|
|
№ 3
|
|
|
+12
|
12
|
|
|
№ 4
|
|
80
|
|
120
|
|
|
№ 5
|
15
|
|
|
|
31
|
Абсолютная масса атома
Атомы — очень малые частицы, поэтому численные значения абсолютных масс для атомов приблизительно будут порядка от 10−23 до 10−22 г, например, абсолютная масса атома хлора составляет 5,89 ∙ 10−23 г. При проведении расчётов очень неудобно использовать такие численные значения, поэтому перешли от абсолютных к относительным массам.
Атомная единица массы (а. е. м.) — это часть абсолютной массы атома углерода. Атомная единица массы обозначается буковой u.
Относительная атомная масса элемента — безразмерная величина, равная отношению средней абсолютной массы атома (учитывая изотопное распределение) элемента к атомной единице массы, т. е. к массы атома изотопа 12С. Например, серебро находится в природе в виде двух изотопов — 107Ag (52 % по массе) и 109Ag (48 % по массе).
Значения средних (с учётом изотопного распределения) относительных атомных масс элементов приведены в периодической таблице Д. И. Менделеева.
Пример 3
Рассчитайте массу трёх атомов кислорода.
Решение
Упражнение 2
Рассчитайте массу:
- 7 атомов фосфора;
- 13 атомов серебра;
- 25 атомов меди;
- 30 атомов цинка.
Нуклиды
Нуклиды — атом элемента с определённым количеством протонов и нейтронов.
К нуклидам относят изотопы, изобары, изотоны.
Изотопы — разные нуклиды одного химического элемента, имеющие одинаковое число протонов, но разное число нейтронов в ядре.
Изотопы — нуклиды с одинаковым Z, но различным A и N.
Изотопы кислорода: .
Изотопы водорода: — протий; — дейтерий; — тритий.
Изотопы калия: .
Изотоны — разновидности атомов разных химических элементов, имеющие одинаковое число нейтронов, но разные атомные номера.
Изотоны — нуклиды с одинаковым N, но различным Z и A.
Изобары — разновидности атомов разных химических элементов, имеющих одинаковые массовые числа, но разные атомные номера.
Изобары — нуклиды с одинаковым A, но различным Z и N.
Химический элемент — вид атомов с одинаковым зарядом ядер (Z).
Пример 4
Ядро нуклида состоит из 20 протонов и 20 нейтронов. Заполните клетки:
Решение
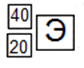
Пример 5
Природный хлор состоит из двух стабильных изотопов: 35С1 и 37С1. Исходя из средней относительной атомной массы хлора, равной 35,45, рассчитайте изотопный состав хлора в процентах по массе.
Решение
Пусть х — мольная доля 35С1, у — мольная доля 37С1, тогда
Решая эту систему, находим х = 0,775, у = 0,225.
Массовые доли изотопов:
.
Ответ:
Упражнение 3
Решите расчётные задачи.
- Природное серебро состоит из двух стабильных изотопов: 107Ag и 109Ag. Исходя из средней относительной атомной массы серебра, равной 107,87, рассчитайте изотопный состав серебра в процентах по массе.
- Природная медь состоит из двух стабильных изотопов: 63Сu и 65Сu. Исходя из средней относительной атомной массы меди, равной 63,55, рассчитайте изотопный состав меди в процентах по массе.
- Природный бром состоит из двух стабильных изотопов: 79Вr и 81Вr. Исходя из средней относительной атомной массы брома, равной 79,90, рассчитайте изотопный состав брома в процентах по массе.
Контрольные вопросы
- Как называются частицы, которыми образованы все вещества?
- Что находится в центре атома?
- Из чего состоит ядро атома?
- Какое общее название имеют протоны и нейтроны?
- Чему равен заряд протона в условных единицах?
- Какой заряд имеют ядра атомов? Почему?
- Как называются частицы, которые движутся вокруг ядра атома?
- Чему равен заряд электрона в условных единицах?
- Какое общее название имеют протоны, нейтроны и электроны?
- Почему атомы являются электронейтральными частицами?
- Что является главной характеристикой любого атома?
- Чему равен заряд ядра атома?
- Что называется химическим элементом?
- Сколько химических элементов известно в настоящее время?
Упражнение 1
|
Атом
|
Число протонов
|
Число электронов
|
Заряд ядра (Z)
|
Число нейтронов
|
Число нуклонов
|
|
№ 1
|
1
|
1
|
+1
|
0
|
1
|
|
№ 2
|
6
|
6
|
+6
|
6
|
12
|
|
№ 3
|
12
|
12
|
+12
|
12
|
24
|
|
№ 4
|
80
|
80
|
+80
|
120
|
200
|
|
№ 5
|
15
|
15
|
+15
|
16
|
31
|
Упражнение 2
Упражнение 3
- Атом
- Абсолютная масса атома
- Относительная атомная масса
- Нуклиды
- знать понятия: атом, электрон, протон, нейтрон и состав ядра, протонное, нейтронное и массовое число, атомная единица массы, относительная атомная масса, нуклиды, изотопы, изобары, изотоны, химический элемент
- уметь определять количество протонов, нейтронов и электронов, рассчитывать абсолютную атомную массу атомов, составлять формулу нуклида, рассчитать изотопный состав химического элемента
 Рис. 1. Демокрит
Рис. 1. Демокрит
Греческий философ Демокрит (460–370 г. до н. э.) был первым человеком, который догадался, что все вещества состоят из крошечных частичек, которые нельзя разделить на более мелкие. Он и назвал эти частички атомами, что по-гречески значит «неделимые».
 Рис. 2. Амедео Авогадро
Рис. 2. Амедео Авогадро
Итальянский физик и химик Амедео Авогадро
(1776–1856) доказал, что атомы объединяются в молекулы. Он также установил, что равные объёмы любых газов при одинаковых температуре и давлении содержат одинаковое количество молекул. На основании этого открытия (сегодня мы знаем его как закон Авогадро) он смог придумать метод определения атомной и молекулярной массы всех химических элементов.
Атом
Атом — электронейтральная частица, которая состоит из положительно заряженного ядра и отрицательно заряженных электронов. Атомы могут существовать как в свободном состоянии, так и связанными с атомами того же элемента или других элементов, образуя молекулы.
 Рис. 3. Изображение атомов кристалла празеодима
Рис. 3. Изображение атомов кристалла празеодима
Физики смогли «сфотографировать» отдельные атомы в рекордном разрешении. Искажения, которые можно увидеть на фотографии, обусловлены тепловыми колебаниями самих атомов. Используемая техника называется птихография. Исследователи планируют ещё больше улучшить изображение, охладив образец: это уменьшит дрожь атомов и приведёт к ещё более чёткой фотографии.
 Схема 1. Строение атома
Схема 1. Строение атома
Протоны, нейтроны и электроны называются элементарными частицами.
|
Название
|
Обозначение
|
Масса
|
Заряд
|
|
Электрон
|
|
|
|
|
Протон
|
p
|
1
|
|
|
Нейтрон
|
n
|
1
|
0
|
Электрон — частица с отрицательным электрическим зарядом. Имеет свойства волны. Электроны, которые движутся вокруг ядер атомов, образуют электронные оболочки, определяющие электрические, оптические и химические свойства атомов и молекул. Важную роль играют валентные электроны, которые принимают участие в образовании химических связей, обычно это электроны внешнего слоя.
Протон — это частица, которая имеет положительный заряд. Заряд протона в условных единицах равен +1. Символ протона — 1р.
Нейтрон — нейтральная частица, заряд нейтрона равен 0. Символ нейтрона — 0n.
Состав атомного ядра описывается формулой:
.
Z — протонное число, показывает число протонов в ядре и их суммарную массу (относительную);
N — нейтронное число, показывает число нейтронов в ядре и их суммарную массу (относительную);
А — массовое (нуклонное) число — это сумма нейтронов и протонов в ядре и их суммарная масса (относительная).
 Схема 2. Порядковый номер
Схема 2. Порядковый номер
Пример 1
Сколько электронов, протонов и нейтронов имеет сера-32?
Решение
32
16S — масса атома записывается в левом верхнем углу относительно элемента, а порядковый номер — в левом нижнем углу.
e = 16 — количество электронов принимаем равным порядковому номеру элемента
p = 16 — количество электронов принимаем равным порядковому номеру элемента
n = 32 − 16 = 16 — количество нейтронов равно разности между массовым числом и количеством протонов
Пример 2
Сколько нейтронов содержит ядра атомов
Решение
N(n)Cl = A − Z = 37 − 17 = 20
N(n)O = A − Z = 18 − 8 = 10
N(n)Si = A − Z = 30 − 14 = 16
N(n)F = A − Z = 19 − 9 = 10
Упражнение 1
Заполните свободные клетки в следующей таблице (каждая строка в таблице соответствует одному атому).
|
Атом
|
Число протонов
|
Число электронов
|
Заряд ядра (Z)
|
Число нейтронов
|
Число нуклонов
|
|
№ 1
|
1
|
|
|
0
|
|
|
№ 2
|
|
6
|
|
|
12
|
|
№ 3
|
|
|
+12
|
12
|
|
|
№ 4
|
|
80
|
|
120
|
|
|
№ 5
|
15
|
|
|
|
31
|
Абсолютная масса атома
Атомы — очень малые частицы, поэтому численные значения абсолютных масс для атомов приблизительно будут порядка от 10−23 до 10−22 г, например, абсолютная масса атома хлора составляет 5,89 ∙ 10−23 г. При проведении расчётов очень неудобно использовать такие численные значения, поэтому перешли от абсолютных к относительным массам.
Атомная единица массы (а. е. м.) — это часть абсолютной массы атома углерода. Атомная единица массы обозначается буковой u.
Относительная атомная масса элемента — безразмерная величина, равная отношению средней абсолютной массы атома (учитывая изотопное распределение) элемента к атомной единице массы, т. е. к массы атома изотопа 12С. Например, серебро находится в природе в виде двух изотопов — 107Ag (52 % по массе) и 109Ag (48 % по массе).
Значения средних (с учётом изотопного распределения) относительных атомных масс элементов приведены в периодической таблице Д. И. Менделеева.
Пример 3
Рассчитайте массу трёх атомов кислорода.
Решение
Упражнение 2
Рассчитайте массу:
- 7 атомов фосфора;
- 13 атомов серебра;
- 25 атомов меди;
- 30 атомов цинка.
Нуклиды
Нуклиды — атом элемента с определённым количеством протонов и нейтронов.
К нуклидам относят изотопы, изобары, изотоны.
Изотопы — разные нуклиды одного химического элемента, имеющие одинаковое число протонов, но разное число нейтронов в ядре.
Изотопы — нуклиды с одинаковым Z, но различным A и N.
Изотопы кислорода: .
Изотопы водорода: — протий; — дейтерий; — тритий.
Изотопы калия: .
Изотоны — разновидности атомов разных химических элементов, имеющие одинаковое число нейтронов, но разные атомные номера.
Изотоны — нуклиды с одинаковым N, но различным Z и A.
Изобары — разновидности атомов разных химических элементов, имеющих одинаковые массовые числа, но разные атомные номера.
Изобары — нуклиды с одинаковым A, но различным Z и N.
Химический элемент — вид атомов с одинаковым зарядом ядер (Z).
Пример 4
Ядро нуклида состоит из 20 протонов и 20 нейтронов. Заполните клетки:
Решение

Пример 5
Природный хлор состоит из двух стабильных изотопов: 35С1 и 37С1. Исходя из средней относительной атомной массы хлора, равной 35,45, рассчитайте изотопный состав хлора в процентах по массе.
Решение
Пусть х — мольная доля 35С1, у — мольная доля 37С1, тогда
Решая эту систему, находим х = 0,775, у = 0,225.
Массовые доли изотопов:
.
Ответ:
Упражнение 3
Решите расчётные задачи.
- Природное серебро состоит из двух стабильных изотопов: 107Ag и 109Ag. Исходя из средней относительной атомной массы серебра, равной 107,87, рассчитайте изотопный состав серебра в процентах по массе.
- Природная медь состоит из двух стабильных изотопов: 63Сu и 65Сu. Исходя из средней относительной атомной массы меди, равной 63,55, рассчитайте изотопный состав меди в процентах по массе.
- Природный бром состоит из двух стабильных изотопов: 79Вr и 81Вr. Исходя из средней относительной атомной массы брома, равной 79,90, рассчитайте изотопный состав брома в процентах по массе.
Контрольные вопросы
- Как называются частицы, которыми образованы все вещества?
- Что находится в центре атома?
- Из чего состоит ядро атома?
- Какое общее название имеют протоны и нейтроны?
- Чему равен заряд протона в условных единицах?
- Какой заряд имеют ядра атомов? Почему?
- Как называются частицы, которые движутся вокруг ядра атома?
- Чему равен заряд электрона в условных единицах?
- Какое общее название имеют протоны, нейтроны и электроны?
- Почему атомы являются электронейтральными частицами?
- Что является главной характеристикой любого атома?
- Чему равен заряд ядра атома?
- Что называется химическим элементом?
- Сколько химических элементов известно в настоящее время?
Упражнение 1
|
Атом
|
Число протонов
|
Число электронов
|
Заряд ядра (Z)
|
Число нейтронов
|
Число нуклонов
|
|
№ 1
|
1
|
1
|
+1
|
0
|
1
|
|
№ 2
|
6
|
6
|
+6
|
6
|
12
|
|
№ 3
|
12
|
12
|
+12
|
12
|
24
|
|
№ 4
|
80
|
80
|
+80
|
120
|
200
|
|
№ 5
|
15
|
15
|
+15
|
16
|
31
|
Упражнение 2
Упражнение 3

