- Ионная связь
- Свойства ионной связи
- знать понятия: ионная связь, ион, катион, анион, окисление, восстановление, шкала Полинга, ненаправленность и ненасыщаемость связи, ионная кристаллическая решётка
- уметь определять тип связи соединений, вещества ионного строения, прогнозировать физические свойства веществ с ионной кристаллической решёткой
Вступление
Вещества имеют различное строение. Среди них только благородные газы — гелий Не, неон Ne, аргон Аr, криптон Кr, ксенон Хе и радон Rn — существуют в виде свободных (изолированных) атомов (схема 1).
 Схема 1. Электронные формулы атомов благородных газов
Схема 1. Электронные формулы атомов благородных газов
Все другие вещества состоят из связанных атомов. Силы, которые обусловливают связь между атомами, получили название «химическая связь». Природа этих сил электростатическая. Результатом связывания атомов является образование более сложных структур — молекул, молекулярных ионов, свободных радикалов, а также ионных, атомных и металлических кристаллических решёток.
Существование этих структур обусловлено различными типами химической связи.
Учение о химической связи — важнейший вопрос современной химии. Без него невозможно объяснить причины многообразия химических веществ, механизма их образования, строения и реакционной способности.
Ионная связь
Ионная связь — это связь, осуществляемая за счёт электростатического взаимодействия противоположно заряженных ионов (схема 2).
Ион — это частица, имеющая заряд.
Положительно заряженные ионы — катионы.
Отрицательно заряженные ионы — анионы.
Процесс отдачи электронов частицей — окисление.
Процесс присоединения электронов частицей — восстановление.
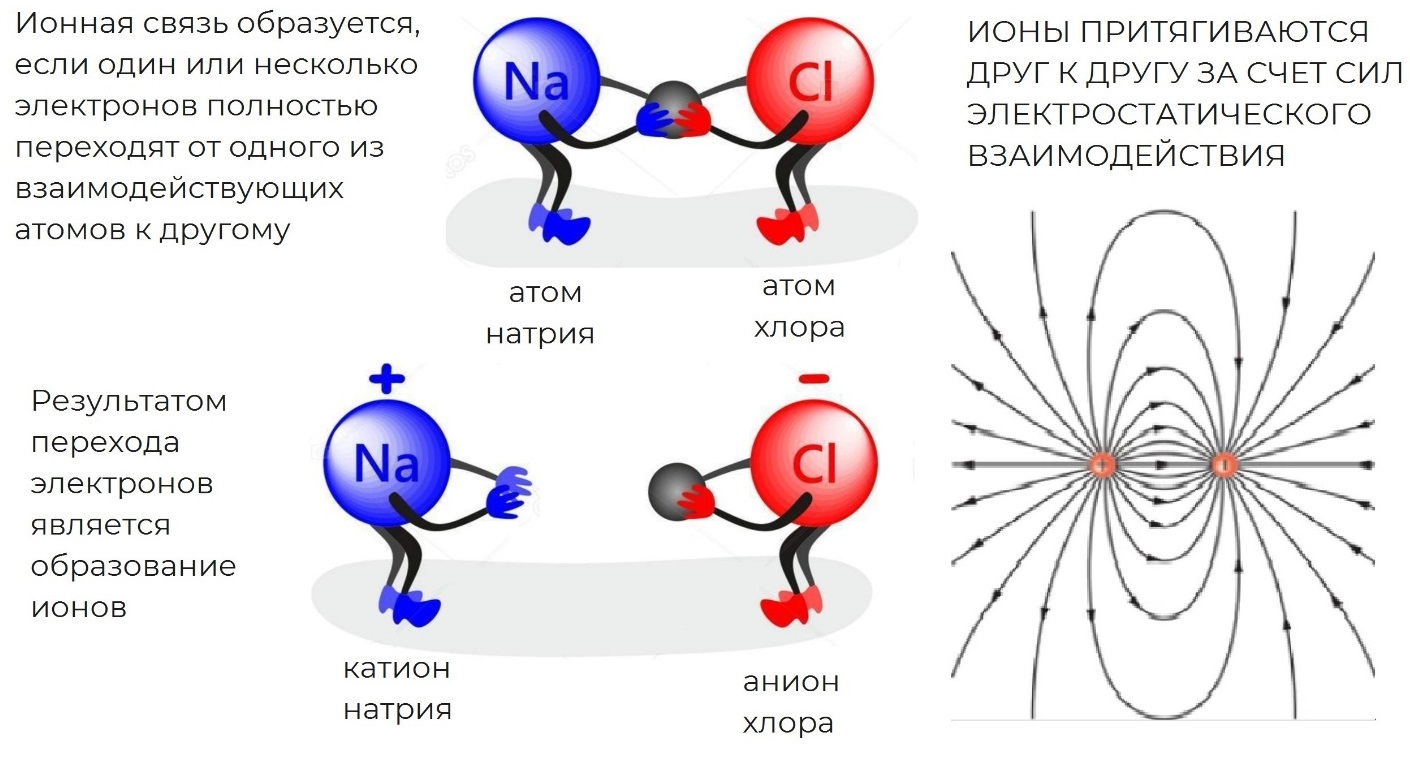 Схема 2. Схема образования ионной связи
Схема 2. Схема образования ионной связи
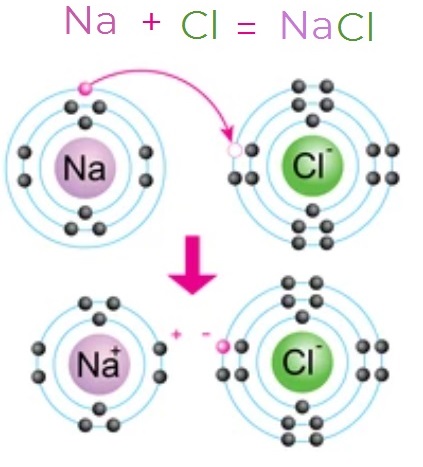 Схема 3. Схема образования ионной связи в молекуле хлорида натрия
Схема 3. Схема образования ионной связи в молекуле хлорида натрия
Процесс образования ионной связи сводится к переходу электронов от атома типичного металла (элементы I и IIА групп) к атомам типичного неметалла (элементы VIIА группы, О и N).
Например, при образовании хлорида натрия атом натрия отдаёт один электрон (схема 3):
.
Атом хлора принимает этот электрон:
.
Между ионами возникают силы электростатического притяжения, в результате чего образуется ионное соединение — хлорид натрия:
.
Величина заряда аниона равна числу принятых атомом неметалла электронов.
Ионную связь рассматривают как крайний случай ковалентной полярной связи, так как резкой границы между ионной и ковалентной связями нет.
Тип связи можно приблизительно определить по разности электроотрицательностей () связанных атомов.
Условно принято считать, что при > 1,7 связь считается ионной.
Относительные электроотрицательности (ЭО) элементов.
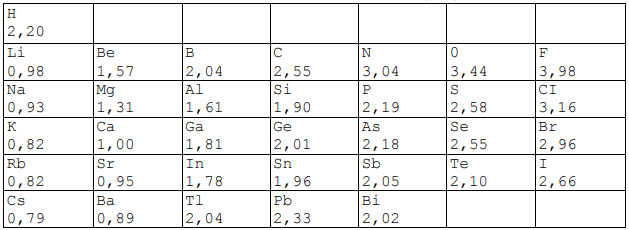 Таблица 1. Значения ЭО элементов по Полингу
Таблица 1. Значения ЭО элементов по Полингу
В шкале Полинга ЭО фтора (наиболее электроотрицательного из всех элементов) условно принята равной 3,98; на втором месте находится кислород, на третьем — хлор. Далее следуют водород и типичные неметаллы; значения их ЭО близки к 2. Активные металлы имеют значения ЭО меньше, чем 1,6. Также ряд электроотрицательности используется для определения окислительных и восстановительных свойств элементов побочных подгрупп.
Шкалу Полинга можно представить в виде ряда электроотрицательностей.
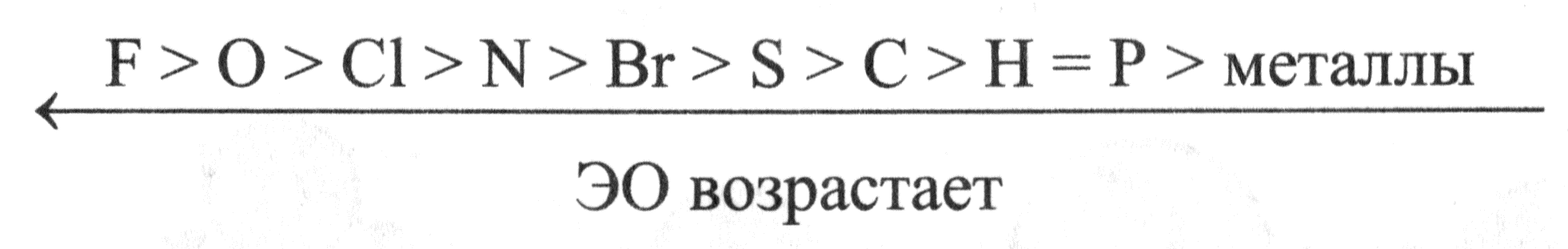
В типичных ионных соединениях, например, в галогенидах щелочных металлов, не происходит полного перехода электрона от одного атома к другому. Например, в кристалле эффективный отрицательный заряд атома хлора составляет около 0,9 заряда электрона (а не 1); таким же по абсолютной величине положительным зарядом обладает и атом натрия.
Пример 1
Определите тип связи в соединении
Решение
разность электроотрицательностей атомов равна
связь ионная.
разность электроотрицательностей равна
связь ковалентная полярная.
Упражнение 1
Определите тип связи в соединении
Свойства ионной связи
Ионная связь в отличие от ковалентной характеризуется ненаправленностью в пространстве и ненасыщаемостью.
Ненаправленность определяется тем, что каждый ион имеет сферическую форму электрического поля и может притягивать ионы противоположного знака по любому направлению. Сила притяжения ионов зависит только от расстояния между ними и не зависит от их взаимной ориентации.
Ненасыщаемость объясняется тем, что взаимодействие ионов противоположного знака не приводит к компенсации их силовых полей и у них сохраняется способность притягивать ионы противоположного знака.
Однако вокруг каждого иона расположено ограниченное число противоионов. Координационное число иона не зависит от его заряда, а определяется соотношением размеров ионов разного знака. Наиболее устойчивая кристаллическая структура образуется, когда катион и анион имеют близкие размеры.
За счёт ионной связи образованы:
- оксиды и галогениды металлов I и IIА групп —
- щёлочи —
- соли кислородосодержащих кислот —
- алкоголяты щелочных и щелочноземельных металлов (I и IIА групп) —
- соли органических кислот —
- соли аминов, аминокислот —
Энергия ионной связи велика, поэтому большинство ионных соединений представляет собой кристаллические вещества с высокими температурами плавления и кипения.
Для ионных соединений понятие молекул типа теряет смысл. Каждый кристалл представляет собой одну огромную молекулу и состоит из большого числа ионов. Отдельные молекулы могут существовать лишь в газовой фазе при температуре выше температуры кипения. Химическая формула ионного соединения описывает состав формульной единицы вещества.
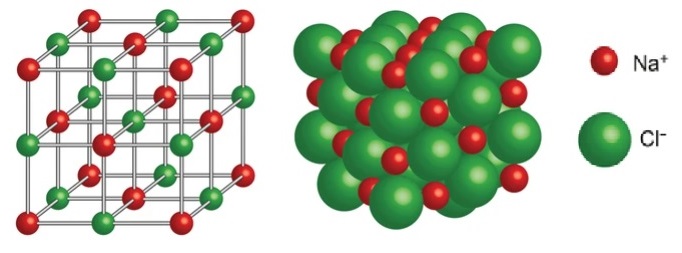 Рис. 1. Ионная кристаллическая решётка
Рис. 1. Ионная кристаллическая решётка
Например, в кристаллической решётке хлорида натрия . Каждый ион натрия окружён шестью хлорид-ионами , каждый хлорид-ион окружён шестью ионами натрия (рис. 1).
Существуют вещества, молекулы которых содержат и ионные, и ковалентные связи. К таким веществам относятся, например, щёлочи и многие соли. Так, в молекулах гидроксида натрия и сульфата натрия связи между атомами натрия и кислорода представляют собой ионные связи, а остальные связи (между атомами кислорода и водорода в и между атомами кислорода и серы в ) — ковалентные полярные.
Пример 2
№ 1. Из предложенного перечня выберите два вещества ионного строения.
1) 4)
2) 5)
3)
№ 2. Из предложенного перечня выберите два вещества, в которых присутствуют и ковалентные, и ионные связи.
1) 4)
2) 5)
3)
№ 3. Только ионные связи присутствуют в
1) 3)
2) 4)
Решение
№ 1. Большинство соединений металлов имеет ионное строение. В данном перечне таких соединений два: Первое состоит из ионов второе — из ионов
№ 2. Прежде всего отбросим два газообразных вещества молекулярного строения, в которых нет ионных связей, — Оставшиеся соединения имеют ионное строение. Но в нет ковалентных связей, так как он образован одноатомными ионами. В ковалентные связи есть в карбонат-ионе а в — в ионе аммония Таким образом, условия удовлетворяют вещества 1 и 5.
Ответ: 1, 5.
№3. В веществах 2–4 есть катионы или анионы, состоящие из двух неметаллов: Атомы неметаллов в этих ионах связаны между собой ковалентными связями, которых, по условию, быть не должно. Ковалентные связи отсутствуют в который образован одноатомными ионами
Ответ: 1.
Упражнение 2
1. Для соединений с ионным типом связи характерны следующие свойства:
1) хрупкость,
2) легкоплавкость,
3) твёрдость,
4) пластичность,
5) электролитическая диссоциация растворов,
6) летучесть.
Запишите номера правильных ответов в порядке возрастания.
2. Определите соединения с ионными кристаллическими решётками:
1) , 2) ,
3) , 4) ,
5) , 6) .
Запишите номера правильных ответов в порядке возрастания.
Контрольные вопросы
- Что называется ионной связью? Между атомами каких элементов она образуется?
- Какой заряд имеют ионы металлов? Как они называются?
- В какие ионы превращаются атомы неметаллов при присоединении электронов?
- Чем обусловлены ненаправленность и ненасыщаемость ионной связи?
- Что находится в узлах кристаллической решётки металлов и что — между узлами?
Ответы
Упражнение 1
— связь можно считать ионной.
Упражнение 2
1. 1, 3, 5
2. 1, 2, 4
- Ионная связь
- Свойства ионной связи
- знать понятия: ионная связь, ион, катион, анион, окисление, восстановление, шкала Полинга, ненаправленность и ненасыщаемость связи, ионная кристаллическая решётка
- уметь определять тип связи соединений, вещества ионного строения, прогнозировать физические свойства веществ с ионной кристаллической решёткой
Вступление
Вещества имеют различное строение. Среди них только благородные газы — гелий Не, неон Ne, аргон Аr, криптон Кr, ксенон Хе и радон Rn — существуют в виде свободных (изолированных) атомов (схема 1).
 Схема 1. Электронные формулы атомов благородных газов
Схема 1. Электронные формулы атомов благородных газов
Все другие вещества состоят из связанных атомов. Силы, которые обусловливают связь между атомами, получили название «химическая связь». Природа этих сил электростатическая. Результатом связывания атомов является образование более сложных структур — молекул, молекулярных ионов, свободных радикалов, а также ионных, атомных и металлических кристаллических решёток.
Существование этих структур обусловлено различными типами химической связи.
Учение о химической связи — важнейший вопрос современной химии. Без него невозможно объяснить причины многообразия химических веществ, механизма их образования, строения и реакционной способности.
Ионная связь
Ионная связь — это связь, осуществляемая за счёт электростатического взаимодействия противоположно заряженных ионов (схема 2).
Ион — это частица, имеющая заряд.
Положительно заряженные ионы — катионы.
Отрицательно заряженные ионы — анионы.
Процесс отдачи электронов частицей — окисление.
Процесс присоединения электронов частицей — восстановление.
 Схема 2. Схема образования ионной связи
Схема 2. Схема образования ионной связи
 Схема 3. Схема образования ионной связи в молекуле хлорида натрия
Схема 3. Схема образования ионной связи в молекуле хлорида натрия
Процесс образования ионной связи сводится к переходу электронов от атома типичного металла (элементы I и IIА групп) к атомам типичного неметалла (элементы VIIА группы, О и N).
Например, при образовании хлорида натрия атом натрия отдаёт один электрон (схема 3):
.
Атом хлора принимает этот электрон:
.
Между ионами возникают силы электростатического притяжения, в результате чего образуется ионное соединение — хлорид натрия:
.
Величина заряда аниона равна числу принятых атомом неметалла электронов.
Ионную связь рассматривают как крайний случай ковалентной полярной связи, так как резкой границы между ионной и ковалентной связями нет.
Тип связи можно приблизительно определить по разности электроотрицательностей () связанных атомов.
Условно принято считать, что при > 1,7 связь считается ионной.
Относительные электроотрицательности (ЭО) элементов.
 Таблица 1. Значения ЭО элементов по Полингу
Таблица 1. Значения ЭО элементов по Полингу
В шкале Полинга ЭО фтора (наиболее электроотрицательного из всех элементов) условно принята равной 3,98; на втором месте находится кислород, на третьем — хлор. Далее следуют водород и типичные неметаллы; значения их ЭО близки к 2. Активные металлы имеют значения ЭО меньше, чем 1,6. Также ряд электроотрицательности используется для определения окислительных и восстановительных свойств элементов побочных подгрупп.
Шкалу Полинга можно представить в виде ряда электроотрицательностей.
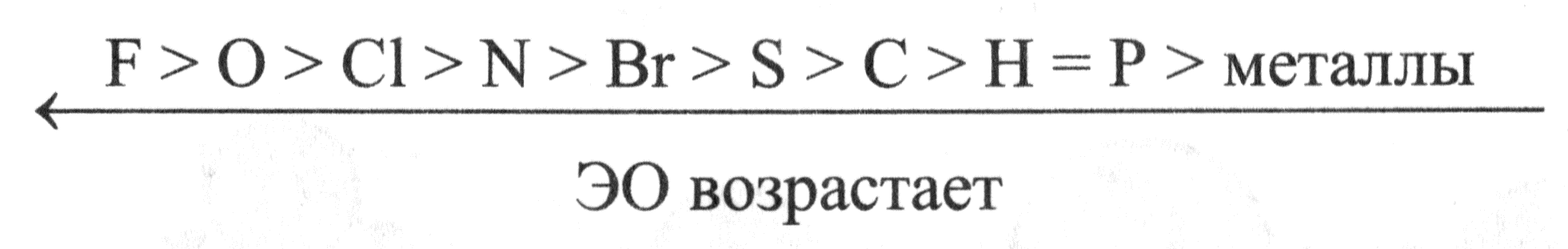
В типичных ионных соединениях, например, в галогенидах щелочных металлов, не происходит полного перехода электрона от одного атома к другому. Например, в кристалле эффективный отрицательный заряд атома хлора составляет около 0,9 заряда электрона (а не 1); таким же по абсолютной величине положительным зарядом обладает и атом натрия.
Пример 1
Определите тип связи в соединении
Решение
разность электроотрицательностей атомов равна
связь ионная.
разность электроотрицательностей равна
связь ковалентная полярная.
Упражнение 1
Определите тип связи в соединении
Свойства ионной связи
Ионная связь в отличие от ковалентной характеризуется ненаправленностью в пространстве и ненасыщаемостью.
Ненаправленность определяется тем, что каждый ион имеет сферическую форму электрического поля и может притягивать ионы противоположного знака по любому направлению. Сила притяжения ионов зависит только от расстояния между ними и не зависит от их взаимной ориентации.
Ненасыщаемость объясняется тем, что взаимодействие ионов противоположного знака не приводит к компенсации их силовых полей и у них сохраняется способность притягивать ионы противоположного знака.
Однако вокруг каждого иона расположено ограниченное число противоионов. Координационное число иона не зависит от его заряда, а определяется соотношением размеров ионов разного знака. Наиболее устойчивая кристаллическая структура образуется, когда катион и анион имеют близкие размеры.
За счёт ионной связи образованы:
- оксиды и галогениды металлов I и IIА групп —
- щёлочи —
- соли кислородосодержащих кислот —
- алкоголяты щелочных и щелочноземельных металлов (I и IIА групп) —
- соли органических кислот —
- соли аминов, аминокислот —
Энергия ионной связи велика, поэтому большинство ионных соединений представляет собой кристаллические вещества с высокими температурами плавления и кипения.
Для ионных соединений понятие молекул типа теряет смысл. Каждый кристалл представляет собой одну огромную молекулу и состоит из большого числа ионов. Отдельные молекулы могут существовать лишь в газовой фазе при температуре выше температуры кипения. Химическая формула ионного соединения описывает состав формульной единицы вещества.
 Рис. 1. Ионная кристаллическая решётка
Рис. 1. Ионная кристаллическая решётка
Например, в кристаллической решётке хлорида натрия . Каждый ион натрия окружён шестью хлорид-ионами , каждый хлорид-ион окружён шестью ионами натрия (рис. 1).
Существуют вещества, молекулы которых содержат и ионные, и ковалентные связи. К таким веществам относятся, например, щёлочи и многие соли. Так, в молекулах гидроксида натрия и сульфата натрия связи между атомами натрия и кислорода представляют собой ионные связи, а остальные связи (между атомами кислорода и водорода в и между атомами кислорода и серы в ) — ковалентные полярные.
Пример 2
№ 1. Из предложенного перечня выберите два вещества ионного строения.
1) 4)
2) 5)
3)
№ 2. Из предложенного перечня выберите два вещества, в которых присутствуют и ковалентные, и ионные связи.
1) 4)
2) 5)
3)
№ 3. Только ионные связи присутствуют в
1) 3)
2) 4)
Решение
№ 1. Большинство соединений металлов имеет ионное строение. В данном перечне таких соединений два: Первое состоит из ионов второе — из ионов
№ 2. Прежде всего отбросим два газообразных вещества молекулярного строения, в которых нет ионных связей, — Оставшиеся соединения имеют ионное строение. Но в нет ковалентных связей, так как он образован одноатомными ионами. В ковалентные связи есть в карбонат-ионе а в — в ионе аммония Таким образом, условия удовлетворяют вещества 1 и 5.
Ответ: 1, 5.
№3. В веществах 2–4 есть катионы или анионы, состоящие из двух неметаллов: Атомы неметаллов в этих ионах связаны между собой ковалентными связями, которых, по условию, быть не должно. Ковалентные связи отсутствуют в который образован одноатомными ионами
Ответ: 1.
Упражнение 2
1. Для соединений с ионным типом связи характерны следующие свойства:
1) хрупкость,
2) легкоплавкость,
3) твёрдость,
4) пластичность,
5) электролитическая диссоциация растворов,
6) летучесть.
Запишите номера правильных ответов в порядке возрастания.
2. Определите соединения с ионными кристаллическими решётками:
1) , 2) ,
3) , 4) ,
5) , 6) .
Запишите номера правильных ответов в порядке возрастания.
Контрольные вопросы
- Что называется ионной связью? Между атомами каких элементов она образуется?
- Какой заряд имеют ионы металлов? Как они называются?
- В какие ионы превращаются атомы неметаллов при присоединении электронов?
- Чем обусловлены ненаправленность и ненасыщаемость ионной связи?
- Что находится в узлах кристаллической решётки металлов и что — между узлами?
Ответы
Упражнение 1
— связь можно считать ионной.
Упражнение 2
1. 1, 3, 5
2. 1, 2, 4

