- Ковалентная связь
- Диполь
- Механизм образования ковалентной связи
- Характеристика ковалентной связи
- Строение веществ с ковалентным типом связи
- знать понятия: ковалентная связь, неполярная и полярная ковалентная связь, диполь, дипольный момент, обменный механизм образования ковалентной связи, одинарная, двойная и тройная ковалентная связи, донорно-акцепторный механизм образования ковалентной связи, полярность связи, энергия связи, порядок (кратность) связи, длина связи, валентный угол, атомная кристаллическая решётка, молекулярная кристаллическая решётка
- уметь составлять схему образования химической связи, определять, какие вещества содержат ковалентные связи, определять, является молекула диполем, определять кратность связи, прогнозировать свойства вещества от его строения
Историческая справка
 Рис. 1. Гилберт Льюис
Рис. 1. Гилберт Льюис
Электронную теорию химической связи предложил в 1916 г. американский химик Гилберт Ньютон Льюис (1875–1946). Электронные оболочки атомов инертных газов обладают особенной стабильностью. Учёный предположил, что при образовании химической связи образуются пары электронов, которые принадлежат сразу двум атомам. Атомы заполняют до конца свой внешний энергетический уровень и приобретают электронную конфигурацию инертного газа.
Льюис назвал это правилом октета, так как атомы всех благородных газов (кроме гелия) имеют на внешнем энергетическом уровне восемь электронов. При помощи правила октета удалось объяснить электронное строение большого числа соединений. В итоге связь, образованная за счёт общей пары электронов, получила название ковалентной.
Ковалентная связь
Ковалентная связь образуется между атомами одного и того же неметалла либо между атомами элементов, незначительно отличающихся по электроотрицательности.
Различают два вида ковалентной связи: неполярную и полярную.
Ковалентная связь — это химическая связь, возникающая в результате образования общих электронных пар между двумя атомами.
Неполярная ковалентная связь — это связь, при которой общая электронная пара принадлежит обоим атомам одинаково, т. е. отсутствует смещение электронной плотности к одному из атомов.
Полярная ковалентная связь — это связь, при которой общая электронная пара смещается к более электроотрицательному атому.
Химическую связь условно обозначают: в виде точек, валентных штрихов (чёрточек), с помощью электронно-графических формул и графического изображения орбиталей.
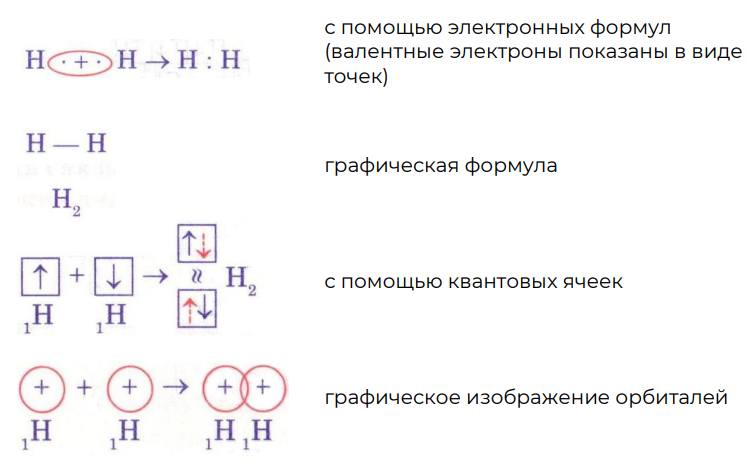 Схема 1. Схема образования ковалентной неполярной связи в молекуле водорода
Схема 1. Схема образования ковалентной неполярной связи в молекуле водорода
При образовании ковалентной полярной связи на атоме, от которого смещается электронная пара, возникает частичный (эффективный) положительный заряд (δ+), а на атоме, к которому смещена электронная пара, — частичный (эффективный) отрицательный заряд (δ−).
Схема образования ковалентной полярной связи (между атомами, незначительно отличающимися по электроотрицательности) ниже.
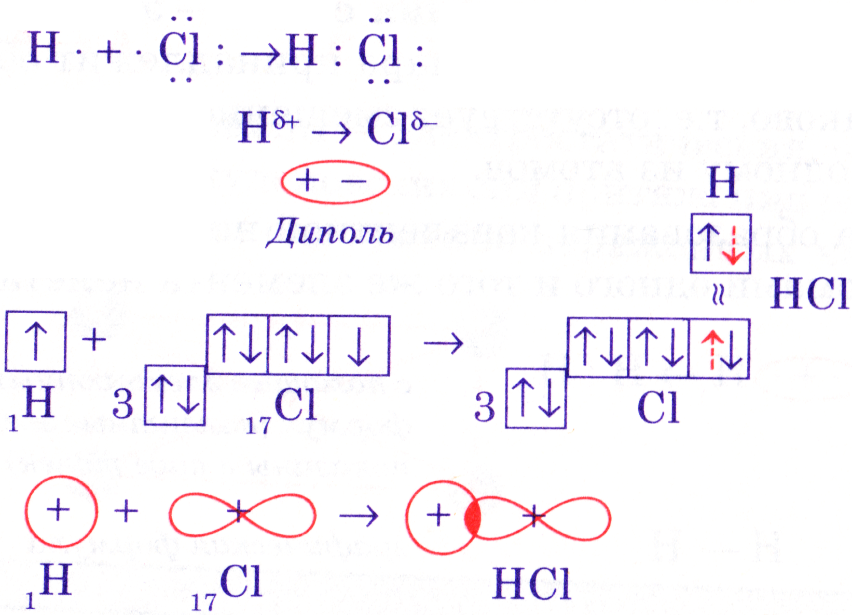 Схема 2. Схема образования молекулы хлороводорода
Схема 2. Схема образования молекулы хлороводорода
Пример 1
Изобразите схему образования сероводорода.
Решение
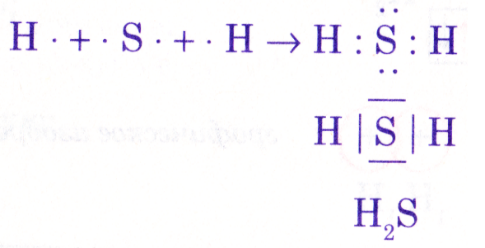
Пример 2
В какой молекуле есть ковалентная неполярная связь?
1) 2) 3) 4)
Решение
Ковалентная неполярная связь может образоваться только между одинаковыми атомами. Среди перечисленных молекул это возможно только в Связь в данной молекуле — ковалентная неполярная. Правильный ответ — 1.
Упражнение 1
Изобразите схему образования молекулы хлора.
Диполь
Диполь — это электронейтральная система, в которой центры положительного и отрицательного зарядов находятся на определённом расстоянии друг от друга.
Схематично диполь изображается следующим образом.
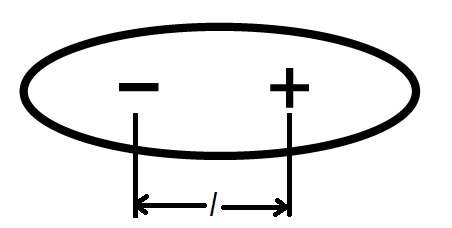
Расстояние между центрами зарядов называется длиной диполя (l). Количественной характеристикой полярности связей молекул является дипольный момент (μ).
Дипольный момент (μ) равен произведению заряда на длину диполя: Чем больше дипольный момент, тем больше полярность связи и молекулы.
Молекулы, имеющие полярные связи, не всегда являются полярными, т. е. диполями, так как полярность молекул определяется не только полярностью связей, но и геометрией молекулы.
Постоянный диполь может существовать только в молекуле, где полярность связи не компенсирована (примеры — молекулы Однако в диполи двух связей взаимно компенсированы и молекула неполярная (рис. 2). Сравнение молекулярной геометрии показывает, что симметрия молекул играет решающую роль в возникновении дипольного элемента у молекул с полярной ковалентной связью.
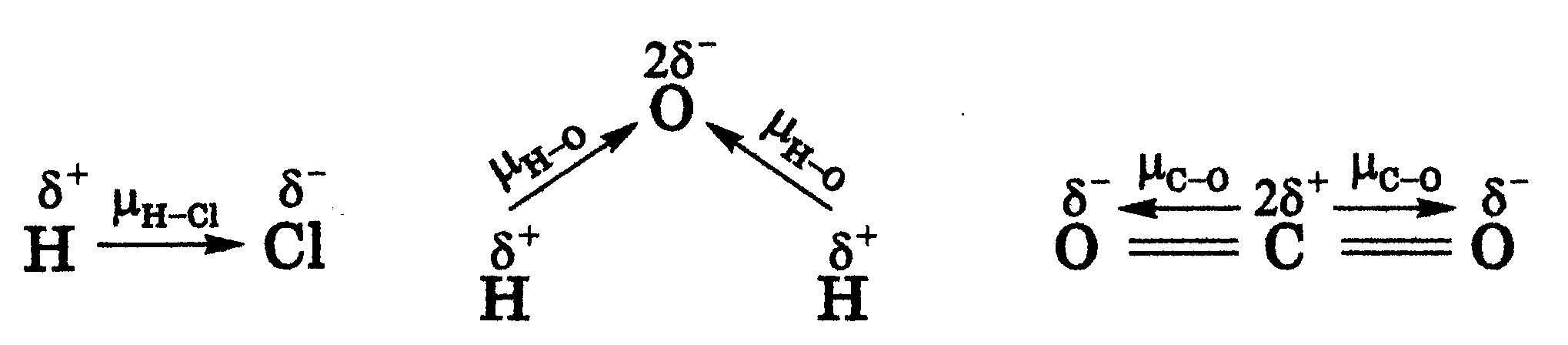 2O и СO2" loading="lazy" />
Рис. 2. Схемы образования диполей молекул HCI, Н2O и СO2
2O и СO2" loading="lazy" />
Рис. 2. Схемы образования диполей молекул HCI, Н2O и СO2
Примером полярной молекулы является молекула хлороводорода (схема 2). Так как ЭО хлора больше ЭО водорода, связь в молекуле является полярной связью. Чем больше разность ЭО связанных атомов, тем сильнее её электронная плотность смещается к атому более электроотрицательного элемента, тем больше дипольный момент молекулы.
Упражнение 2
1. В молекуле аммиака:
1) связи полярные, молекула полярная;
2) связи неполярные, молекула неполярная;
3) связи полярные, молекула неполярная;
4) связи неполярные, молекула полярная.
2. Молекула не является диполем:
1) , 2) , 3) , 4) .
Механизм образования ковалентной связи
Ковалентная связь — связь, осуществляемая за счёт образования общих электронных пар, принадлежащих обоим атомам. Общая пара электронов может быть получена двумя способами:
1) каждый из атомов отдаёт в общее пользование по одному электрону (обменный механизм);
2) один атом отдаёт в общее пользование два электрона, а другой — ни одного (донорно-акцепторный механизм).
Обменный механизм — это механизм, который реализуется при сближении атомов, содержащих неспаренные электроны, электронные оболочки атомов перекрываются. При этом возникает общая пара электронов, одновременно принадлежащая обоим атомам. Каждый атом предоставляет в эту пару по одному неспаренному электрону.
Пример образования одинарной, двойной и тройной связи по обменному механизму ниже.
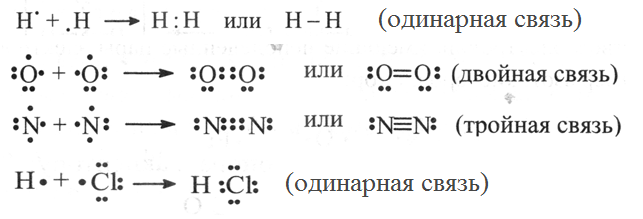
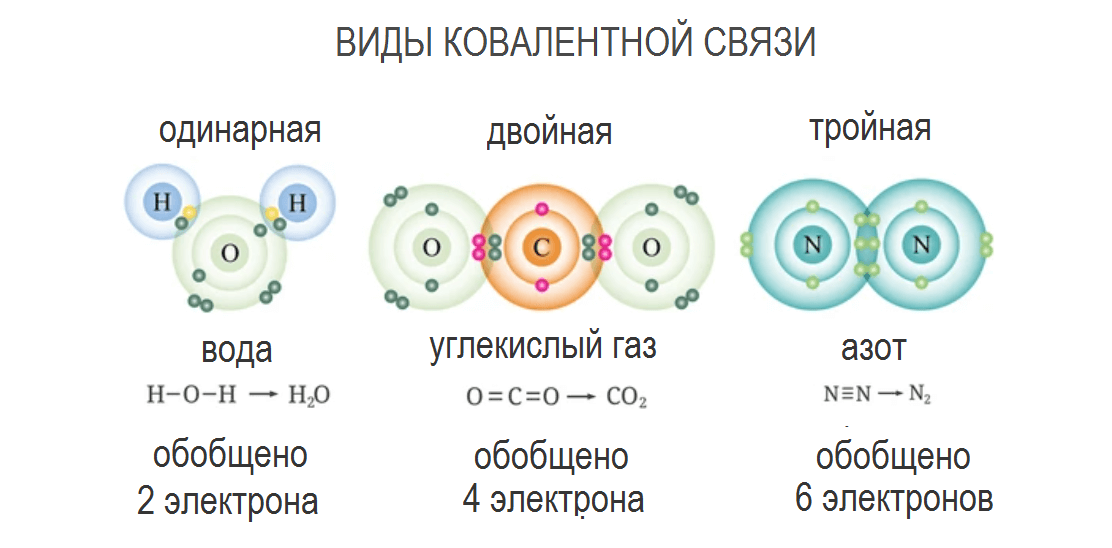 Рис. 3. Виды ковалентной связи
Рис. 3. Виды ковалентной связи
Донорно-акцепторный механизм — это механизм, при котором один атом (донор) вносит неподеленную пару электронов, а другой (акцептор) представляет свободную орбиталь.
Пример образования иона аммония (точками обозначена неподеленная пара электронов атома азота, пустым квадратиком — свободная 1s-орбиталь иона водорода).
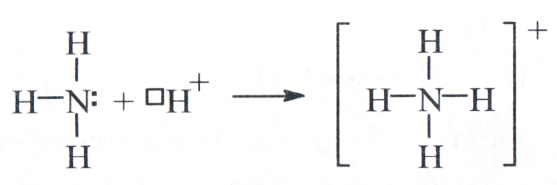
В ионе аммония каждый из четырёх атомов водорода связан с атомом азота общей электронной парой; три пары из четырёх образованы по обменному механизму, одна — по донорно-акцепторному. Все связи образованные по различным механизмам, равноценны.

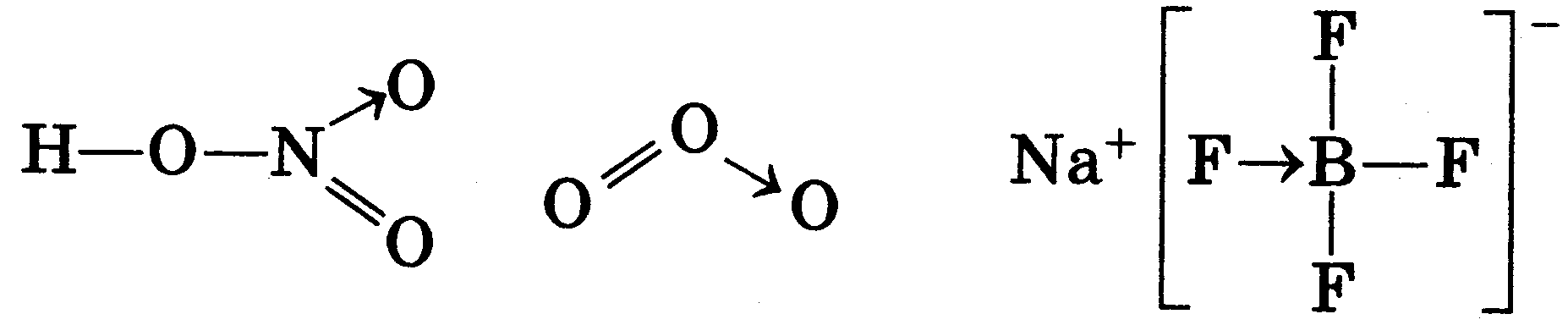
В качестве доноров обычно выступают атомы с большим количеством электронов, имеющие неподеленные пары электронов, например, азот, кислород, фтор.
Есть несколько характерных примеров частиц с донорно-акцепторной связью, которые надо запомнить: и все комплексные частицы.
Донорно-акцепторная связь изображена стрелкой, направленной от донора к акцептору.
Пример 3
В какой молекуле есть двойная связь между атомами?
1) 2) 3) 4)
Решение
В молекулах есть атомы водорода, а водород всегда одновалентен, поэтому все связи в данных молекулах — одинарные. В молекуле есть только четырёхвалентный углерод и двухвалентный кислород. Молекула образована двумя двойными связями: Правильный ответ — 2.
Упражнение 3
1. Донорно-акцепторный механизм образования связи реализуется в соединении:
1) 2) 3) 4)
2. В перечне соединений 1) , 2) , 3) , 4) , 5) , 6) имеют двойную связь:
1) 1, 2, 5, 2) 2, 3, 4, 3) 3, 4, 6, 4) 2, 3, 6.
Характеристика ковалентной связи
- Полярность связи характеризует степень смещения общей электронной пары к одному из атомов.
- Энергия связи — энергия, необходимая для того, чтобы полностью разорвать связь и разделить молекулу на фрагменты.
- Порядок (кратность) связи — число электронных пар, участвующих в образовании связи.
- Длина связи — расстояние между ядрами атомов, образующих связь.
- Валентный угол (угол между связями) — угол между линями, соединяющими химически связанные атомы.
Строение веществ с ковалентным типом связи
Ковалентная связь определяет два типа решёток: молекулярные и атомные.
Атомные кристаллические решётки образованы нейтральными атомами, связанными друг с другом ковалентными связями. Вещества с атомным строением (например, алмаз, кремний) характеризуются большой твёрдостью и высокими температурами плавления и кипения.
Молекулярные кристаллические решётки образованы молекулами, связанными друг с другом слабым вандерваальсовым взаимодействием. Вещества с молекулярным строением (например, твёрдые ) летучи, имеют низкие температуры плавления и кипения.
Упражнение 4
1. Укажите верное суждение:
а) для веществ с ковалентной связью характерны молекулярные кристаллические решётки;
б) для веществ с ковалентной связью характерны атомные кристаллические решётки.
1) верно только а 3) верны оба суждения
2) верно только б 4) оба суждения неверны
2. Для соединений с молекулярной кристаллической решёткой характерны следующие свойства:
1) непрочность, 4) электропроводность,
2) легкоплавкость, 5) высокая температура кипения,
3) твёрдость, 6) летучесть.
Запишите номера правильных ответов в порядке возрастания.
3. Укажите соединения с молекулярными кристаллическими решётками:
1) , 2) , 3) , 4) , 5) , 6) .
Запишите номера правильных ответов в порядке их возрастания.
Контрольные вопросы
- Какие вещества существуют в виде свободных атомов?
- Как объяснял образование ковалентной связи Г. Льюис?
- Как изменяется энергия системы взаимодействующих атомов при образовании химической связи?
- В каком случае ковалентная связь называется одинарной (простой) связью?
- Какие связи называются: а) двойными; б) тройными; в) кратными?
- Что характеризует электроотрицательность элемента?
- Какая связь называется: а) неполярной; б) полярной?
- Что такое диполь? Что называется длиной диполя?
- Чему равен дипольный момент?
- От чего зависит полярность (дипольный момент) двухатомных молекул?
- Является ли молекула воды диполем?
Ответы
Упражнение 1

Упражнение 2
1) 1
2) 2
Упражнение 3
1) 3
2) 1
Упражнение 4
1) 3
2) 1, 2, 6
3) 3, 5, 6
- Ковалентная связь
- Диполь
- Механизм образования ковалентной связи
- Характеристика ковалентной связи
- Строение веществ с ковалентным типом связи
- знать понятия: ковалентная связь, неполярная и полярная ковалентная связь, диполь, дипольный момент, обменный механизм образования ковалентной связи, одинарная, двойная и тройная ковалентная связи, донорно-акцепторный механизм образования ковалентной связи, полярность связи, энергия связи, порядок (кратность) связи, длина связи, валентный угол, атомная кристаллическая решётка, молекулярная кристаллическая решётка
- уметь составлять схему образования химической связи, определять, какие вещества содержат ковалентные связи, определять, является молекула диполем, определять кратность связи, прогнозировать свойства вещества от его строения
Историческая справка
 Рис. 1. Гилберт Льюис
Рис. 1. Гилберт Льюис
Электронную теорию химической связи предложил в 1916 г. американский химик Гилберт Ньютон Льюис (1875–1946). Электронные оболочки атомов инертных газов обладают особенной стабильностью. Учёный предположил, что при образовании химической связи образуются пары электронов, которые принадлежат сразу двум атомам. Атомы заполняют до конца свой внешний энергетический уровень и приобретают электронную конфигурацию инертного газа.
Льюис назвал это правилом октета, так как атомы всех благородных газов (кроме гелия) имеют на внешнем энергетическом уровне восемь электронов. При помощи правила октета удалось объяснить электронное строение большого числа соединений. В итоге связь, образованная за счёт общей пары электронов, получила название ковалентной.
Ковалентная связь
Ковалентная связь образуется между атомами одного и того же неметалла либо между атомами элементов, незначительно отличающихся по электроотрицательности.
Различают два вида ковалентной связи: неполярную и полярную.
Ковалентная связь — это химическая связь, возникающая в результате образования общих электронных пар между двумя атомами.
Неполярная ковалентная связь — это связь, при которой общая электронная пара принадлежит обоим атомам одинаково, т. е. отсутствует смещение электронной плотности к одному из атомов.
Полярная ковалентная связь — это связь, при которой общая электронная пара смещается к более электроотрицательному атому.
Химическую связь условно обозначают: в виде точек, валентных штрихов (чёрточек), с помощью электронно-графических формул и графического изображения орбиталей.
 Схема 1. Схема образования ковалентной неполярной связи в молекуле водорода
Схема 1. Схема образования ковалентной неполярной связи в молекуле водорода
При образовании ковалентной полярной связи на атоме, от которого смещается электронная пара, возникает частичный (эффективный) положительный заряд (δ+), а на атоме, к которому смещена электронная пара, — частичный (эффективный) отрицательный заряд (δ−).
Схема образования ковалентной полярной связи (между атомами, незначительно отличающимися по электроотрицательности) ниже.
 Схема 2. Схема образования молекулы хлороводорода
Схема 2. Схема образования молекулы хлороводорода
Пример 1
Изобразите схему образования сероводорода.
Решение
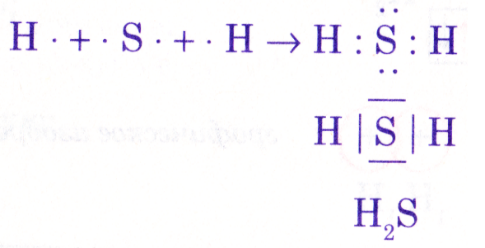
Пример 2
В какой молекуле есть ковалентная неполярная связь?
1) 2) 3) 4)
Решение
Ковалентная неполярная связь может образоваться только между одинаковыми атомами. Среди перечисленных молекул это возможно только в Связь в данной молекуле — ковалентная неполярная. Правильный ответ — 1.
Упражнение 1
Изобразите схему образования молекулы хлора.
Диполь
Диполь — это электронейтральная система, в которой центры положительного и отрицательного зарядов находятся на определённом расстоянии друг от друга.
Схематично диполь изображается следующим образом.

Расстояние между центрами зарядов называется длиной диполя (l). Количественной характеристикой полярности связей молекул является дипольный момент (μ).
Дипольный момент (μ) равен произведению заряда на длину диполя: Чем больше дипольный момент, тем больше полярность связи и молекулы.
Молекулы, имеющие полярные связи, не всегда являются полярными, т. е. диполями, так как полярность молекул определяется не только полярностью связей, но и геометрией молекулы.
Постоянный диполь может существовать только в молекуле, где полярность связи не компенсирована (примеры — молекулы Однако в диполи двух связей взаимно компенсированы и молекула неполярная (рис. 2). Сравнение молекулярной геометрии показывает, что симметрия молекул играет решающую роль в возникновении дипольного элемента у молекул с полярной ковалентной связью.
 2O и СO2" loading="lazy" />
Рис. 2. Схемы образования диполей молекул HCI, Н2O и СO2
2O и СO2" loading="lazy" />
Рис. 2. Схемы образования диполей молекул HCI, Н2O и СO2
Примером полярной молекулы является молекула хлороводорода (схема 2). Так как ЭО хлора больше ЭО водорода, связь в молекуле является полярной связью. Чем больше разность ЭО связанных атомов, тем сильнее её электронная плотность смещается к атому более электроотрицательного элемента, тем больше дипольный момент молекулы.
Упражнение 2
1. В молекуле аммиака:
1) связи полярные, молекула полярная;
2) связи неполярные, молекула неполярная;
3) связи полярные, молекула неполярная;
4) связи неполярные, молекула полярная.
2. Молекула не является диполем:
1) , 2) , 3) , 4) .
Механизм образования ковалентной связи
Ковалентная связь — связь, осуществляемая за счёт образования общих электронных пар, принадлежащих обоим атомам. Общая пара электронов может быть получена двумя способами:
1) каждый из атомов отдаёт в общее пользование по одному электрону (обменный механизм);
2) один атом отдаёт в общее пользование два электрона, а другой — ни одного (донорно-акцепторный механизм).
Обменный механизм — это механизм, который реализуется при сближении атомов, содержащих неспаренные электроны, электронные оболочки атомов перекрываются. При этом возникает общая пара электронов, одновременно принадлежащая обоим атомам. Каждый атом предоставляет в эту пару по одному неспаренному электрону.
Пример образования одинарной, двойной и тройной связи по обменному механизму ниже.
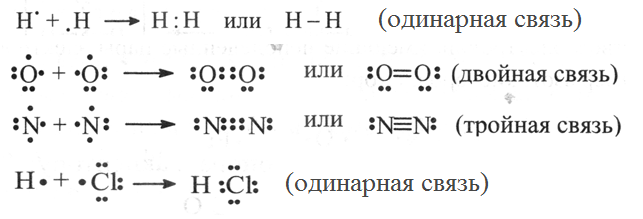
 Рис. 3. Виды ковалентной связи
Рис. 3. Виды ковалентной связи
Донорно-акцепторный механизм — это механизм, при котором один атом (донор) вносит неподеленную пару электронов, а другой (акцептор) представляет свободную орбиталь.
Пример образования иона аммония (точками обозначена неподеленная пара электронов атома азота, пустым квадратиком — свободная 1s-орбиталь иона водорода).

В ионе аммония каждый из четырёх атомов водорода связан с атомом азота общей электронной парой; три пары из четырёх образованы по обменному механизму, одна — по донорно-акцепторному. Все связи образованные по различным механизмам, равноценны.

В качестве доноров обычно выступают атомы с большим количеством электронов, имеющие неподеленные пары электронов, например, азот, кислород, фтор.
Есть несколько характерных примеров частиц с донорно-акцепторной связью, которые надо запомнить: и все комплексные частицы.
Донорно-акцепторная связь изображена стрелкой, направленной от донора к акцептору.

Пример 3
В какой молекуле есть двойная связь между атомами?
1) 2) 3) 4)
Решение
В молекулах есть атомы водорода, а водород всегда одновалентен, поэтому все связи в данных молекулах — одинарные. В молекуле есть только четырёхвалентный углерод и двухвалентный кислород. Молекула образована двумя двойными связями: Правильный ответ — 2.
Упражнение 3
1. Донорно-акцепторный механизм образования связи реализуется в соединении:
1) 2) 3) 4)
2. В перечне соединений 1) , 2) , 3) , 4) , 5) , 6) имеют двойную связь:
1) 1, 2, 5, 2) 2, 3, 4, 3) 3, 4, 6, 4) 2, 3, 6.
Характеристика ковалентной связи
- Полярность связи характеризует степень смещения общей электронной пары к одному из атомов.
- Энергия связи — энергия, необходимая для того, чтобы полностью разорвать связь и разделить молекулу на фрагменты.
- Порядок (кратность) связи — число электронных пар, участвующих в образовании связи.
- Длина связи — расстояние между ядрами атомов, образующих связь.
- Валентный угол (угол между связями) — угол между линями, соединяющими химически связанные атомы.
Строение веществ с ковалентным типом связи
Ковалентная связь определяет два типа решёток: молекулярные и атомные.
Атомные кристаллические решётки образованы нейтральными атомами, связанными друг с другом ковалентными связями. Вещества с атомным строением (например, алмаз, кремний) характеризуются большой твёрдостью и высокими температурами плавления и кипения.
Молекулярные кристаллические решётки образованы молекулами, связанными друг с другом слабым вандерваальсовым взаимодействием. Вещества с молекулярным строением (например, твёрдые ) летучи, имеют низкие температуры плавления и кипения.
Упражнение 4
1. Укажите верное суждение:
а) для веществ с ковалентной связью характерны молекулярные кристаллические решётки;
б) для веществ с ковалентной связью характерны атомные кристаллические решётки.
1) верно только а 3) верны оба суждения
2) верно только б 4) оба суждения неверны
2. Для соединений с молекулярной кристаллической решёткой характерны следующие свойства:
1) непрочность, 4) электропроводность,
2) легкоплавкость, 5) высокая температура кипения,
3) твёрдость, 6) летучесть.
Запишите номера правильных ответов в порядке возрастания.
3. Укажите соединения с молекулярными кристаллическими решётками:
1) , 2) , 3) , 4) , 5) , 6) .
Запишите номера правильных ответов в порядке их возрастания.
Контрольные вопросы
- Какие вещества существуют в виде свободных атомов?
- Как объяснял образование ковалентной связи Г. Льюис?
- Как изменяется энергия системы взаимодействующих атомов при образовании химической связи?
- В каком случае ковалентная связь называется одинарной (простой) связью?
- Какие связи называются: а) двойными; б) тройными; в) кратными?
- Что характеризует электроотрицательность элемента?
- Какая связь называется: а) неполярной; б) полярной?
- Что такое диполь? Что называется длиной диполя?
- Чему равен дипольный момент?
- От чего зависит полярность (дипольный момент) двухатомных молекул?
- Является ли молекула воды диполем?
Ответы
Упражнение 1

Упражнение 2
1) 1
2) 2
Упражнение 3
1) 3
2) 1
Упражнение 4
1) 3
2) 1, 2, 6
3) 3, 5, 6



