- Идеальный газ
- Закон Бойля – Мариотта
- Закон Шарля
- Закон Гей-Люссака
- знать, что такое идеальный газ
- знать закон Бойля – Мариотта
- знать закон Шарля
- знать закон Гей-Люссака
- Что называют температурой тела?
- Сформулируйте первое начало термодинамики.
- Что называют термодинамической системой?
Идеальный газ
Из нулевого начала термодинамики следует, что любая полностью изолированная термодинамическая система с течением времени приходит в состояние термодинамического равновесия. Такое её состояние можно охарактеризовать набором макропараметров: температурой , давлением , объёмом , массой или количеством вещества. Стоит заметить, что эти макропараметры термодинамической системы, находящейся в состоянии термодинамического равновесия, не могут принимать произвольные значения. Они связаны между собой уравнением состояния вещества.
Переход термодинамической системы из одного состояния в другое называют термодинамическим процессом. В термодинамике мы ограничимся рассмотрением таких процессов, в которых состояние термодинамической системы изменяется настолько медленно, что в любой момент времени систему можно считать находящейся в состоянии термодинамического равновесия. Такие процессы будем называть равновесными.
Простейшей термодинамической системой является газ. Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа, в которой молекулы газа рассматриваются как упругие точечные шарики.
Модель идеального газа:
- Силы взаимодействия между молекулами или между атомами отсутствуют;
- Молекулы имеют достаточно малые размеры по сравнению со средним расстоянием между ними (суммарный объём всех молекул много меньше объёма сосуда, в котором находится газ);
- Столкновения молекул газа между собой и со стенкой являются абсолютно упругими, то есть внутреннее состояние молекул не изменяется.
Закон Бойля – Мариотта
При рассмотрении процессов, происходящих с газом, будем считать количество вещества неизменной величиной. Таким образом, изменяться будут термодинамические параметры: температура, давление, объём. Большую часть процессов в газах, которые наблюдаются в природе и осуществляются в тепловых машинах, можно рассматривать приближённо как процессы, в которых изменяются лишь два макропараметра. Особую роль в физике и технике играют три процесса: изотермический, изохорный и изобарный, о каждом из которых пойдёт речь дальше.
Изотермическим процессом называется процесс, протекающий при постоянной температуре . Было установлено, что при постоянной температуре и неизменных значениях массы газа и его молярной массы (неизменном количестве вещества) произведение давления газа на его объём остаётся постоянным:
.
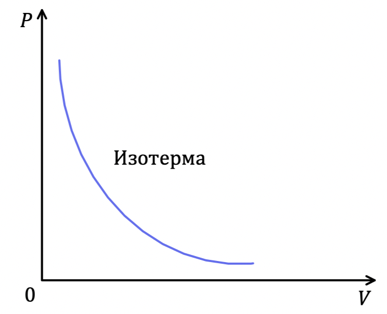 Рис. 1. Изотермический процесс
Рис. 1. Изотермический процесс
Изотермический процесс можно осуществить, например, путём изменения объёма газа при постоянной температуре. С точки зрения МКТ данный процесс можно представить на примере сжатия газа. Объём газа уменьшается, а значит количество ударов, приходящихся на единицу площади сосуда, в котором содержится газ, будет возрастать — давление возрастёт. Таким образом, если объём уменьшится в 5 раз при неизменной температуре, то давление возрастёт в 5 раз. График изотермического процесса называется изотермой. Изотерма, изображённая в прямоугольной системе координат, по оси ординат которой отсчитывается давление газа, а по оси абсцисс — его объём, является гиперболой (см. рис. 1). Уравнение , устанавливающее связь между давлением и объёмом газа при постоянной температуре, было получено из эксперимента до создания молекулярно-кинетической теории газов в 1662 г. английским физиком Робертом Бойлем и в 1676 г. французским физиком Эдмом Мариоттом. Потому изотермический процесс описывается законом Бойля – Мариотта.
Закон Бойля – Мариотта
Для заданного количества идеального газа произведение давления газа на его объём остаётся постоянным, если температура газа не меняется:
, при и .
Закон Бойля – Мариотта при решении задач часто записывают в виде
,
где и — давление и объём газа в состоянии 1, а и — давление и объём газа в состоянии 2 при условии, что температуры газа в состояниях 1 и 2 равны .
Пример 1
Идеальный газ изотермически сжимается, при этом его объём уменьшился в 6 раз. Как изменится давление этого газа?
Решение
1. Поскольку процесс является изотермическим, то воспользуемся законом Бойля –Мариотта:
.
2. Введём следующие обозначения:
.
3. Найдём давление :
;
.
Ответ: давление увеличится в 6 раз.
Упражнение 1
1. Идеальный газ сжимают изотермически от объёма 20 л до объёма 10 л. Давление газа при этом возрастает на = 10 кПа. Определите первоначальное давление .
Закон Шарля
Следующий процесс, который мы рассмотрим, называется изохорным. Изохорный процесс — это такой процесс, который протекает при неизменном объёме и условии . При этих условиях отношение давления к температуре остаётся неизменным:
.
 Рис. 2. Изохорный процесс
Рис. 2. Изохорный процесс
Изохорный процесс можно осуществить, например, нагреванием воздуха при постоянном объёме. С точки зрения МКТ можно представить себе следующую ситуацию: газ нагревают, тем самым увеличивают темп хаотического движения молекул, а поскольку объём постоянный, то количество ударов, приходящихся на единицу площади сосуда, в котором содержится газ, будет возрастать — давление возрастёт. Таким образом, если увеличить температуру газа в 5 раз при неизменном объёме, то давление этого газа возрастёт в те же самые 5 раз. График уравнения изохорного процесса называется изохорой. Изохора, изображённая в прямоугольной системе координат, по оси ординат которой отсчитывается давление газа, а по оси абсцисс — его абсолютная температура, является прямой (линейная зависимость), проходящей через начало координат (см. рис. 2). Экспериментальным путём зависимость давления газа от температуры исследовал французский физик Жак Шарль в 1787 г. Поэтому уравнение называется законом Шарля.
Закон Шарля
Для заданного количества идеального газа отношение давления газа к его абсолютной температуре остаётся постоянным, если объём газа не меняется:
, при и .
Альтернативная запись закона Шарля для идеального газа выглядит следующим образом:
,
где и — давление и температура газа в состоянии 1, а и — давление и температура газа в состоянии 2 при условии, что объёмы газа в состояниях 1 и 2 равны ().
Пример 2
Как изменится давление идеального газа в закрытом сосуде, если его температуру уменьшить в 8 раз?
Решение
1. Закрытый сосуд означает, что объём в термодинамических процессах с газом будет постоянным, то есть процесс будет изобарным. Запишем закон Шарля:
.
2. Введём следующие обозначения:
.
3. Найдём давление :
;
.
Ответ: давление уменьшится в 8 раз.
Упражнение 2
1. В закрытом сосуде при температуре 27 °С давление идеального газа 600 кПа. Каким будет давление этого газа при температуре −23 °С?
2. При какой температуре находился идеальный газ в закрытом сосуде, если при нагревании на 300 К его давление возросло в 3 раза?
Закон Гей-Люссака
Остался заключительный процесс, протекающий при неизменном давлении и при неизменном количестве вещества . Данный процесс называют изобарным, иногда можно встретить название изобарический. При этих условиях отношение объёма к температуре остаётся неизменным:
.
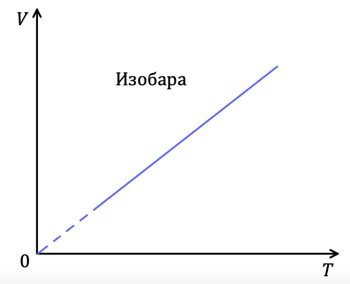 Рис. 3. Изобарный процесс
Рис. 3. Изобарный процесс
Изобарный процесс происходит, например, при нагревании или охлаждении воздуха при постоянном давлении. С точки зрения МКТ при увеличении температуры газа темп хаотического движения молекул будет расти, тогда, чтобы давление оставалось неизменным, количество ударов на единицу площади сосуда должно оставаться постоянным, а это возможно лишь при увеличении объёма. График уравнения изобарного процесса называется изобарой. Изобара, изображённая в прямоугольной системе координат, по оси ординат которой отсчитывается объём газа, а по оси абсцисс — его абсолютная температура, является прямой, проходящей через начало координат (см. рис. 3). Экспериментальное исследование зависимости объёма газа от температуры провёл в 1802 г. французский физик Жозеф Гей-Люссак. Поэтому уравнение называется законом Гей-Люссака.
Закон Гей-Люссака
Для заданного количества идеального газа отношение объёма газа к его абсолютной температуре остаётся постоянным, если давление газа не меняется:
, при и .
Альтернативная запись закона Гей-Люссака для идеального газа можно записать так:
,
где и — объём и температура газа в состоянии 1, а и — объём и температура газа в состоянии 2 при условии, что давление газа в состояниях 1 и 2 равно ().
Пример 3
Как изменится температура идеального газа, если объём изобарически увеличить в 7 раз?
Решение
1. Поскольку процесс изобарический, то воспользуемся законом Гей-Люссака:
.
2. Введём следующие обозначения:
.
3. Найдём давление :
;
.
Ответ: температура увеличится в 7 раз.
Упражнение 3
1. Идеальный газ изобарически нагревают, в результате чего его температура увеличивается в 28 раз. Как изменится объём газа в результате данного процесса?
Контрольные вопросы
1. Какими макропараметрами характеризуется система в термодинамическом равновесии?
2. Что предполагается в модели идеального газа?
3. Как выглядит зависимость давления от объёма в изотермическом процессе?
4. Сформулируйте закон Бойля – Мариотта.
5. Что называют изохорическим процессом?
6. Сформулируйте закон Шарля.
7. Что называют изобарическим процессом?
8. Сформулируйте закон Гей-Люссака.
Упражнение 1
1. 10 кПа
Упражнение 2
1. 500 кПа
2. 150 К
Упражнение 3
1. Увеличится в 28 раз
- Идеальный газ
- Закон Бойля – Мариотта
- Закон Шарля
- Закон Гей-Люссака
- знать, что такое идеальный газ
- знать закон Бойля – Мариотта
- знать закон Шарля
- знать закон Гей-Люссака
- Что называют температурой тела?
- Сформулируйте первое начало термодинамики.
- Что называют термодинамической системой?
Идеальный газ
Из нулевого начала термодинамики следует, что любая полностью изолированная термодинамическая система с течением времени приходит в состояние термодинамического равновесия. Такое её состояние можно охарактеризовать набором макропараметров: температурой , давлением , объёмом , массой или количеством вещества. Стоит заметить, что эти макропараметры термодинамической системы, находящейся в состоянии термодинамического равновесия, не могут принимать произвольные значения. Они связаны между собой уравнением состояния вещества.
Переход термодинамической системы из одного состояния в другое называют термодинамическим процессом. В термодинамике мы ограничимся рассмотрением таких процессов, в которых состояние термодинамической системы изменяется настолько медленно, что в любой момент времени систему можно считать находящейся в состоянии термодинамического равновесия. Такие процессы будем называть равновесными.
Простейшей термодинамической системой является газ. Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа, в которой молекулы газа рассматриваются как упругие точечные шарики.
Модель идеального газа:
- Силы взаимодействия между молекулами или между атомами отсутствуют;
- Молекулы имеют достаточно малые размеры по сравнению со средним расстоянием между ними (суммарный объём всех молекул много меньше объёма сосуда, в котором находится газ);
- Столкновения молекул газа между собой и со стенкой являются абсолютно упругими, то есть внутреннее состояние молекул не изменяется.
Закон Бойля – Мариотта
При рассмотрении процессов, происходящих с газом, будем считать количество вещества неизменной величиной. Таким образом, изменяться будут термодинамические параметры: температура, давление, объём. Большую часть процессов в газах, которые наблюдаются в природе и осуществляются в тепловых машинах, можно рассматривать приближённо как процессы, в которых изменяются лишь два макропараметра. Особую роль в физике и технике играют три процесса: изотермический, изохорный и изобарный, о каждом из которых пойдёт речь дальше.
Изотермическим процессом называется процесс, протекающий при постоянной температуре . Было установлено, что при постоянной температуре и неизменных значениях массы газа и его молярной массы (неизменном количестве вещества) произведение давления газа на его объём остаётся постоянным:
.
 Рис. 1. Изотермический процесс
Рис. 1. Изотермический процесс
Изотермический процесс можно осуществить, например, путём изменения объёма газа при постоянной температуре. С точки зрения МКТ данный процесс можно представить на примере сжатия газа. Объём газа уменьшается, а значит количество ударов, приходящихся на единицу площади сосуда, в котором содержится газ, будет возрастать — давление возрастёт. Таким образом, если объём уменьшится в 5 раз при неизменной температуре, то давление возрастёт в 5 раз. График изотермического процесса называется изотермой. Изотерма, изображённая в прямоугольной системе координат, по оси ординат которой отсчитывается давление газа, а по оси абсцисс — его объём, является гиперболой (см. рис. 1). Уравнение , устанавливающее связь между давлением и объёмом газа при постоянной температуре, было получено из эксперимента до создания молекулярно-кинетической теории газов в 1662 г. английским физиком Робертом Бойлем и в 1676 г. французским физиком Эдмом Мариоттом. Потому изотермический процесс описывается законом Бойля – Мариотта.
Закон Бойля – Мариотта
Для заданного количества идеального газа произведение давления газа на его объём остаётся постоянным, если температура газа не меняется:
, при и .
Закон Бойля – Мариотта при решении задач часто записывают в виде
,
где и — давление и объём газа в состоянии 1, а и — давление и объём газа в состоянии 2 при условии, что температуры газа в состояниях 1 и 2 равны .
Пример 1
Идеальный газ изотермически сжимается, при этом его объём уменьшился в 6 раз. Как изменится давление этого газа?
Решение
1. Поскольку процесс является изотермическим, то воспользуемся законом Бойля –Мариотта:
.
2. Введём следующие обозначения:
.
3. Найдём давление :
;
.
Ответ: давление увеличится в 6 раз.
Упражнение 1
1. Идеальный газ сжимают изотермически от объёма 20 л до объёма 10 л. Давление газа при этом возрастает на = 10 кПа. Определите первоначальное давление .
Закон Шарля
Следующий процесс, который мы рассмотрим, называется изохорным. Изохорный процесс — это такой процесс, который протекает при неизменном объёме и условии . При этих условиях отношение давления к температуре остаётся неизменным:
.
 Рис. 2. Изохорный процесс
Рис. 2. Изохорный процесс
Изохорный процесс можно осуществить, например, нагреванием воздуха при постоянном объёме. С точки зрения МКТ можно представить себе следующую ситуацию: газ нагревают, тем самым увеличивают темп хаотического движения молекул, а поскольку объём постоянный, то количество ударов, приходящихся на единицу площади сосуда, в котором содержится газ, будет возрастать — давление возрастёт. Таким образом, если увеличить температуру газа в 5 раз при неизменном объёме, то давление этого газа возрастёт в те же самые 5 раз. График уравнения изохорного процесса называется изохорой. Изохора, изображённая в прямоугольной системе координат, по оси ординат которой отсчитывается давление газа, а по оси абсцисс — его абсолютная температура, является прямой (линейная зависимость), проходящей через начало координат (см. рис. 2). Экспериментальным путём зависимость давления газа от температуры исследовал французский физик Жак Шарль в 1787 г. Поэтому уравнение называется законом Шарля.
Закон Шарля
Для заданного количества идеального газа отношение давления газа к его абсолютной температуре остаётся постоянным, если объём газа не меняется:
, при и .
Альтернативная запись закона Шарля для идеального газа выглядит следующим образом:
,
где и — давление и температура газа в состоянии 1, а и — давление и температура газа в состоянии 2 при условии, что объёмы газа в состояниях 1 и 2 равны ().
Пример 2
Как изменится давление идеального газа в закрытом сосуде, если его температуру уменьшить в 8 раз?
Решение
1. Закрытый сосуд означает, что объём в термодинамических процессах с газом будет постоянным, то есть процесс будет изобарным. Запишем закон Шарля:
.
2. Введём следующие обозначения:
.
3. Найдём давление :
;
.
Ответ: давление уменьшится в 8 раз.
Упражнение 2
1. В закрытом сосуде при температуре 27 °С давление идеального газа 600 кПа. Каким будет давление этого газа при температуре −23 °С?
2. При какой температуре находился идеальный газ в закрытом сосуде, если при нагревании на 300 К его давление возросло в 3 раза?
Закон Гей-Люссака
Остался заключительный процесс, протекающий при неизменном давлении и при неизменном количестве вещества . Данный процесс называют изобарным, иногда можно встретить название изобарический. При этих условиях отношение объёма к температуре остаётся неизменным:
.
 Рис. 3. Изобарный процесс
Рис. 3. Изобарный процесс
Изобарный процесс происходит, например, при нагревании или охлаждении воздуха при постоянном давлении. С точки зрения МКТ при увеличении температуры газа темп хаотического движения молекул будет расти, тогда, чтобы давление оставалось неизменным, количество ударов на единицу площади сосуда должно оставаться постоянным, а это возможно лишь при увеличении объёма. График уравнения изобарного процесса называется изобарой. Изобара, изображённая в прямоугольной системе координат, по оси ординат которой отсчитывается объём газа, а по оси абсцисс — его абсолютная температура, является прямой, проходящей через начало координат (см. рис. 3). Экспериментальное исследование зависимости объёма газа от температуры провёл в 1802 г. французский физик Жозеф Гей-Люссак. Поэтому уравнение называется законом Гей-Люссака.
Закон Гей-Люссака
Для заданного количества идеального газа отношение объёма газа к его абсолютной температуре остаётся постоянным, если давление газа не меняется:
, при и .
Альтернативная запись закона Гей-Люссака для идеального газа можно записать так:
,
где и — объём и температура газа в состоянии 1, а и — объём и температура газа в состоянии 2 при условии, что давление газа в состояниях 1 и 2 равно ().
Пример 3
Как изменится температура идеального газа, если объём изобарически увеличить в 7 раз?
Решение
1. Поскольку процесс изобарический, то воспользуемся законом Гей-Люссака:
.
2. Введём следующие обозначения:
.
3. Найдём давление :
;
.
Ответ: температура увеличится в 7 раз.
Упражнение 3
1. Идеальный газ изобарически нагревают, в результате чего его температура увеличивается в 28 раз. Как изменится объём газа в результате данного процесса?
Контрольные вопросы
1. Какими макропараметрами характеризуется система в термодинамическом равновесии?
2. Что предполагается в модели идеального газа?
3. Как выглядит зависимость давления от объёма в изотермическом процессе?
4. Сформулируйте закон Бойля – Мариотта.
5. Что называют изохорическим процессом?
6. Сформулируйте закон Шарля.
7. Что называют изобарическим процессом?
8. Сформулируйте закон Гей-Люссака.
Упражнение 1
1. 10 кПа
Упражнение 2
1. 500 кПа
2. 150 К
Упражнение 3
1. Увеличится в 28 раз



