- Строение алканов. Номенклатура
- Изомерия алканов
- Физические свойства алканов
- Химические свойства алканов
- Получение алканов
- Применение алканов
- научиться составлять структурные формулы алканов
- уметь составлять изомеры алканов и давать им названия
- уметь составлять структурные формулы алканов по названиям веществ
- уметь составлять уравнения химических реакций с участием алканов
- знать основные направления применения алканов
- Какие вы знаете типы химических реакций? В чём особенности реакций замещения, разложения?
- Чем отличаются структурные формулы от молекулярных?
- Составьте структурные формулы следующих веществ: .
- Составьте структурные формулы всех возможных изомеров состава .
Строение алканов. Номенклатура
Алканы являются предельными углеводородами. Это значит, что все связи углерода максимально насыщены атомами водорода. Подобное возможно, если между углеродами отсутствуют кратные связи (двойные и тройные).
Все связи достаточно прочные. По этой причине алканы, состоящие из трёх и более углеродов, целесообразно записывать не прямой линией, а зигзагообразной (рис. 1).
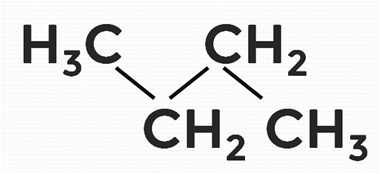 Рисунок 1. Строение бутана
Рисунок 1. Строение бутана
Названия или номенклатура алканов зависят от исторических предпосылок (первые 4 алкана) и от цифр греческого алфавита (начиная с 5 алкана). Визуально это можно представить в виде следующей таблицы (таблица 1).
Таблица 1. Номенклатура алканов
Общая формула алканов . Все алканы между собой отличаются на одну или более групп .
Такие соединения получили название гомологи.
Гомологи — это вещества, относящиеся к одному классу, сходные по составу, строению, свойствам, но различающиеся на одну или несколько групп (гомологическая разность).
Гомологи, как и изомеры, мы будем встречать во всех классах органических веществ.
Если алканы имеют разветвлённое строение, то название им даётся по следующему алгоритму.
- В структурной формуле вещества выбираем самую длинную цепь.
- Атомы углерода нумеруем с конца, к которому ближе разветвления (радикалы).
- Даём название. Сначала записываем названия радикалов с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то перед их названием соответственно ставят частицы ди — два, три — три, тетра — четыре и т. д.
- Затем даём название основной цепи. Допустим, в основной цепи 5 углеродов, следовательно, в конце названия будет пентан.
Пример 1
Дайте название следующему алкану.
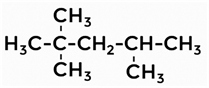
Решение
1. Нумерацию цепи делаем слева, так как у второго атома углерода 2 разветвления (радикала). В случае нумерации справа только один радикал.
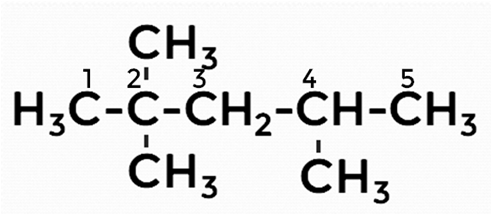
2. Называем радикалы, цифрами указываем их расположение.
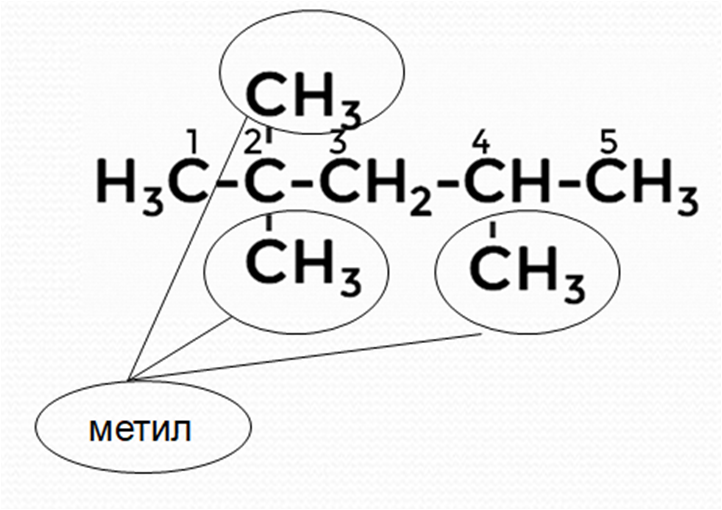
Получается следующее название 2,2,4-триметил...
3. Даём название основной цепи, содержащей 5 атомов углерода (пентан).
В итоге получаем следующее название: 2,2,4-триметилпентан.
Упражнение 1
Составьте сокращённые структурные формулы 2,2-диметилпропана, 2,3-диметилбутана, метилпропана.
Упражнение 2
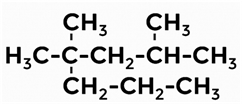
Дайте название следующему алкану.
Изомерия алканов
В молекулах алканов отсутствуют кратные связи, функциональные группы, поэтому для них характерна только структурная изомерия углеродного скелета.
Упражнение 3
Составьте все возможные сокращённые структурные формулы алканов состава , дайте им названия.
Физические свойства алканов
Первые четыре алкана по агрегатному состоянию являются газообразными веществами; с пентана до 15 алкана жидкости. Начиная с 16 алкана, — твёрдые вещества. То есть чем больше молекулярная масса, тем выше плотность. Отсюда и изменение агрегатного состояния вещества.
Химические свойства алканов
Алканы — насыщенные углеводороды, поэтому они не вступают в реакции присоединения. Для них наиболее характерны реакции замещения.
Все типичные реакции алканов можно разделить на две группы: реакции с разрывом связи и реакции с разрывом связи .
Реакции с разрывом связи С – H
Реакции замещения
1. Галогенирование
Атом галогена (в данном случае хлор, реакция — хлорирование) замещает атом водорода. Реакция идёт под действием света. Механизм реакции свободнорадикальный.
2. Нитрование (реакция Коновалова)
Реакция идёт с участием азотной кислоты при повышенном давлении, по свободнорадикальному механизму. Для понимания механизма реакции азотную кислоту () нередко записывают как .
Замещение идёт у углерода с наименьшим количеством атомов водорода. Радикалы и функциональные группы, находящиеся за пределами основной цепи, нередко указывают в скобках.
Реакция отщепления (дегидрирование алканов)
Реакция протекает при высокой температуре в присутствии катализаторов (никель, платина, оксид хрома (III)). При этом образуются непредельные углеводороды — алкены.
Реакции с разрывом связи С – С
1. Горение алканов
Алканы, как и многие органические вещества, сгорают в кислороде с образованием углекислого газа и воды:
.
2. Крекинг алканов
Крекинг — это термическое разложение углеводородов на соединения с более короткой цепью.
В результате данной реакции получается один алкан и один алкен.
Крекинг используется для переработки нефти.
3. Пиролиз
Пиро — с греческого языка огонь, лизис — разложение. Это термическое разложение вещества.
В промышленности часто используется пиролиз метана, протекающий по разному в зависимости от температуры:
,
,
.
4. Изомеризация
Реакция каталитическая (используется катализатор хлорид алюминия), протекает с образованием изомеров. В нашем примере из бутана получается метилпропан (изобутан).
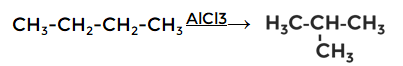
Получение алканов
Промышленные способы получения алканов
1. Крекинг алканов
В промышленности разложением алканов под действием высокой температуры или катализаторов получают как алканы, так и алкены с меньшей углеродной цепочкой.
2. Гидрирование оксида углерода (II)
3. Гидрирование алкенов
Реакция, обратная дегидрированию алканов. Катализаторы: никель, платина.
Лабораторные способы получения алканов
1. Декарбоксилирование (реакция отщепления оксида углерода (IV) из солей карбоновых кислот (реакция Дюма)).
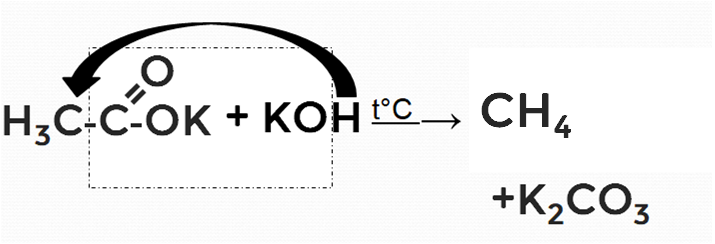 Рисунок 2. Схематическое изображение реакции Дюма
Рисунок 2. Схематическое изображение реакции Дюма
В нашем примере из ацетата калия образуется метан.
2. Реакция Вюрца
В реакциях участвуют галогеналканы со щелочным металлом. В результате удваивается углеродная цепочка. Из 1-хлорпропана образуется гексан.
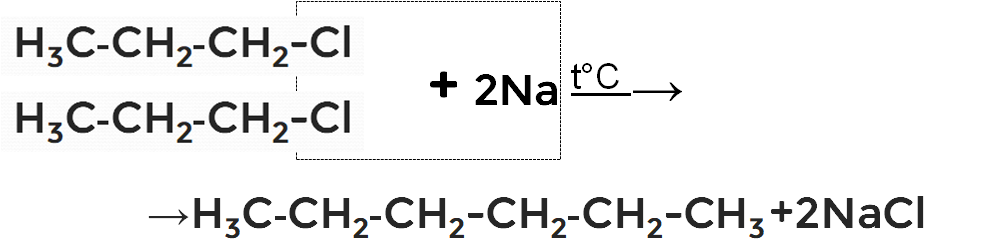 Рисунок 3. Схематическое изображение реакции Вюрца
Рисунок 3. Схематическое изображение реакции Вюрца
3. Гидролиз некоторых карбидов
Применение алканов
Алканы находят широкое применение. В первую очередь в качестве топлива. Природный газ, керосин, бензин содержат в своём составе алканы. Кроме этого, алканы используются в органическом синтезе. Из них получают различные органические соединения.
Самое широкое применение в синтезе находит метан (рис. 4).
 Рисунок 4. Применение метана
Рисунок 4. Применение метана
Упражнение 4
Закончите уравнения химических реакций.
Контрольные вопросы
1. В чём особенности строения алканов? Почему их относят к предельным углеводородам?
2. Какой вид изомерии характерен для алканов?
3. Какие химические свойства типичны для алканов?
4. Назовите способы получения алканов?
5. Как получают алканы в промышленности и в лаборатории?
Упражнение 1
2,2-диметилпропан ,
2,3-диметилбутан ,
метилпропан
Упражнение 2
2, 4, 4-триметилгептан
Упражнение 3
Пентан, 2-метилбутан, 2,2-диметилпропан
Упражнение 4

