- Строение аминов. Классификация. Номенклатура
- Физические свойства аминов
- Химические свойства аминов. Анилин
- Получение аминов
- Применение аминов
- рассмотреть особенности строения и классификации аминов
- научиться составлять структурные формулы аминов, давать им названия
- научиться составлять уравнения химических реакций с участием аминов
- рассмотреть основные способы получения аминов
- рассмотреть применение аминов
- Назовите типичные реакции для оснований.
- Опишите физические свойства аммиака.
- Какие реакции характерны аммиака?
- Как образуется ион аммония? Объясните донорно-акцепторный механизм образования ковалентной полярной связи.
- Какая окраска фенолфталеина и лакмуса в растворе щелочей?
- Какие химические свойства фенола обусловлены его строением?
Строение аминов. Классификация. Номенклатура
Амины относятся к азотсодержащим органическим веществам, всегда имеющим в составе азот.
Их можно представить как производные аммиака, где атомы водорода замещены на 1-3 углеродных радикала.
Классификацию аминов с примерами можно представить в виде следующей схемы (рис. 1).
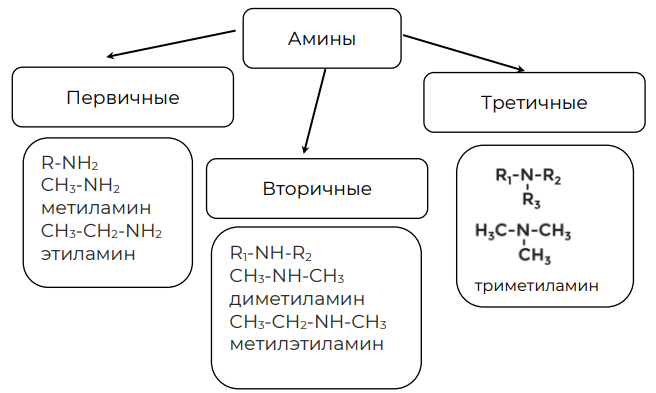 Рисунок 1. Классификация аминов
Рисунок 1. Классификация аминов
Общая формула первичных аминов или . Последняя формула относится ко всем аминам, не только первичным.
Амины — органические соединения, производные аммиака, в молекуле которого несколько атомов водорода замещены на углеводородные радикалы.
Ароматическим амином является фениламин, или анилин.
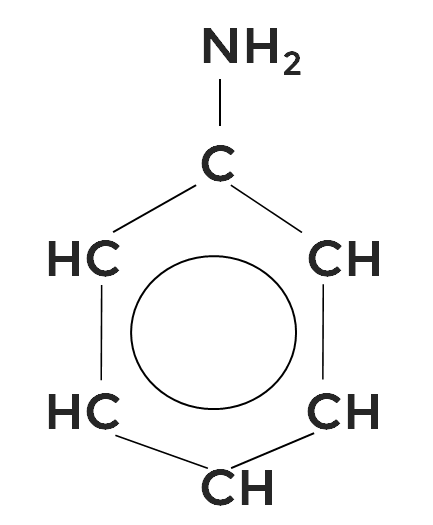
В молекуле анилина бензольное кольцо оттягивает на себя электронную плотность от аминогруппы, поэтому, так же как у фенола, отрицательный заряд локализуется в орто- и пара-положениях и уменьшаются основные свойства по сравнению с предельными аминами.
Упражнение 1
Составьте структурные формулы следующих аминов: пропиламина, изопропиламина, диэтиламина, диметилэтиламина.
Физические свойства аминов
Простейшие амины — газы с запахом аммиака (здесь опять наблюдается сходство с аммиаком), более сложные — жидкости с запахом рыбы, высшие — твёрдые нерастворимые в воде вещества.
Температура кипения и растворимость в воде у аминов меньше, чем у соответствующих спиртов.
Анилин является маслянистой бесцветной жидкостью, плохо растворимой в воде. Ядовит. На воздухе окисляется и приобретает красно-бурую окраску.
Химические свойства аминов. Анилин
Основные свойства аминов
Амины, как и аммиак, проявляют основные свойства. Поэтому индикаторы (метилоранж, фенолфталеин, лакмус) меняют окраску в их растворах.
В реакциях наблюдается сходство аминов с аммиаком.
Поэтому подобно аммиаку они реагируют с водой:
,
гидроксид метиламмония
Образуют соли с кислотами:
,
гидросульфат аммония
,
сульфат аммония
гидросульфат метиламмония
сульфат аммония
сульфат метиламмония
Соли неустойчивы, разлагаются щелочами:
,
.
Анилин
Анилин как все амины проявляет основные свойства, реагируя с кислотами:
.
хлорид фениламмония
Только основные свойства анилина благодаря бензольному кольцу слабее, чем у предельных аминов и даже аммиака.
Таким образом, основные свойства возрастают от анилина к аммиаку, а дальше к аминам — первичным и вторичным:
.
Наличие у анилина бензольного кольца проявляется в реакциях замещения, которые характерны для аренов. Так же как у гомологов бензола и фенола, протекать они будут в орто- и пара-положениях.
Так, при замещении трёх ионов водорода на ионы брома анилин обесцвечивает бромную воду, образуя осадок 2,4,6-триброманилина.
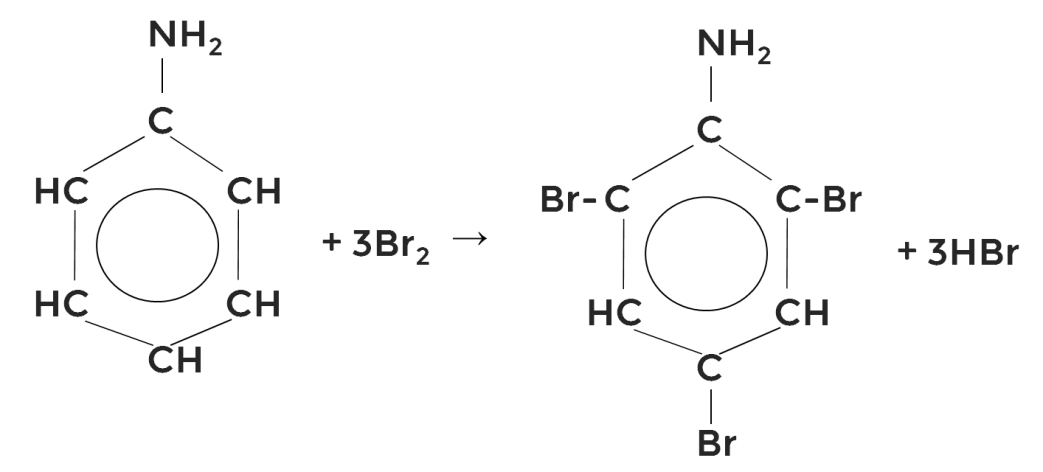
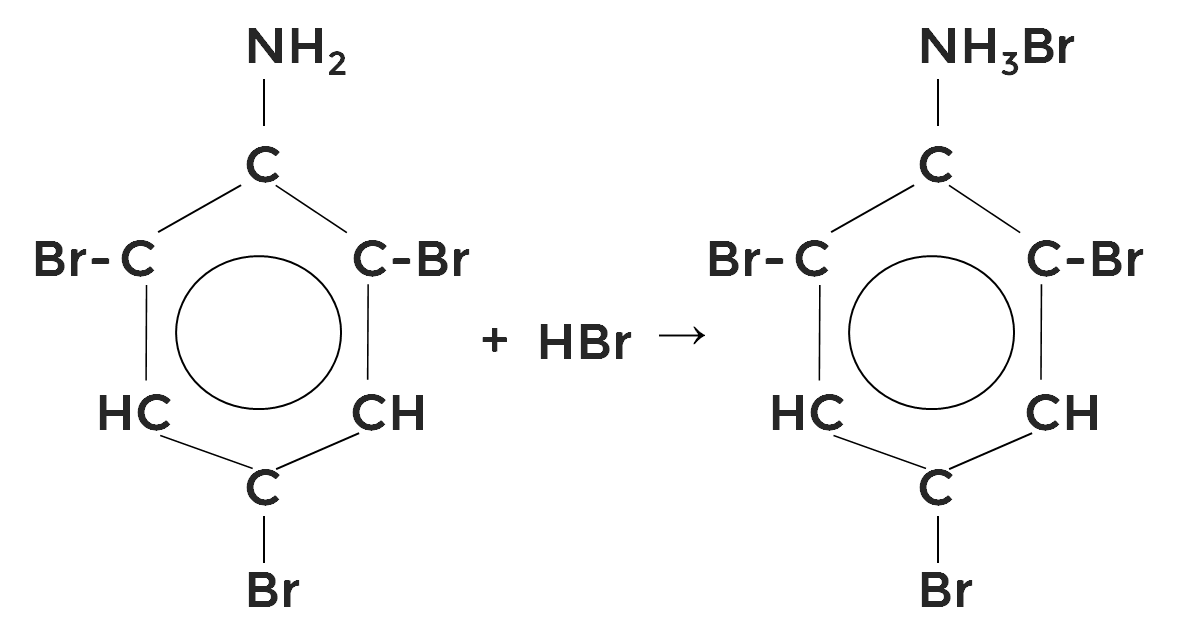
Образующийся бромоводород присоединяется к аминогруппе.
Горение аминов
Амины вступают в реакцию окисления с кислородом. В результате выделяется углекислый газ, вода и молекула азота. Вы помните из курса неорганической химии, что азот горит в кислороде только при очень жёстких условиях например, при электрическом разряде. Поэтому в реакциях горения азотсодержащих веществ азот выделяется в виде простого вещества:
.
Получение аминов
 Рисунок 2. Зинин Николай Николаевич
Рисунок 2. Зинин Николай Николаевич
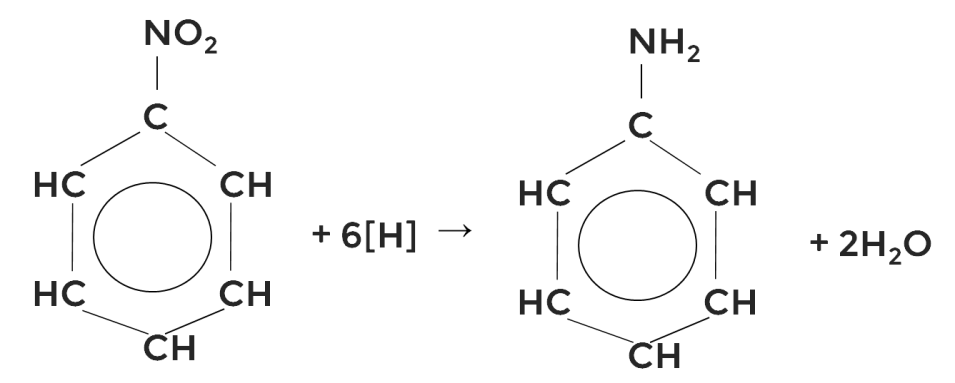
Амины получают восстановлением нитросоединений. Схематически реакция будет выглядеть так:
.
Таким образом можно получить метиламин из нитрометана:
.
Реакцию назвали реакцией Зинина, так как в XIX веке её проводил отечественный учёный Зинин Николай Николаевич для синтеза анилина из нитробензола.
Амины также получаются взаимодействием спиртов с аммиаком. В нашем примере этиламин синтезируется из этанола:
.
Амины возможно получить по реакции аммиака с галогеналканами. Например, этиламин из бромэтана:
.
Довольно часто химические свойства различных классов химических соединений применяют для установления истинной формулы реагирующих веществ.
Пример 1
При взаимодействии предельного первичного амина с азотистой кислотой выделилось 2,24 л газа (н. у.) и образовалось 6 г органического вещества. Установите молекулярную формулу амина.
Решение
1. Записываем исходные данные. Необходимо указать то, что требуется найти. В данном случае необходимо установить молекулярную формулу первичного амина, поэтому запишем её в общем виде.

2. Исходя из знаний о получении одноатомных спиртов, устанавливаем, что при взаимодействии с азотистой кислотой первичного амина образуется органическое вещество — одноатомный спирт, газ азот и вода. Записываем реакцию общем виде.

3. Выбираем вещество, у которого можем вычислить количество вещества, в данном случае — азот.

4. По уравнению реакции видим, что перед амином, спиртом и азотом отсутствуют коэффициенты, значит, количество вещества азота равно количеству вещества амина и спирта. Так как отсутствуют данные об амине, мы можем рассчитать молярную массу спирта.

5. Определим число атомов углерода в молекуле спирта.

6. В результате вычислений нашли «х», который показывает число атомов углерода в молекуле спирта. Из уравнения видим, что число атомов углерода в спирте равно числу атомов углерода в амине. Установим формулу амина и запишем ответ.

Применение аминов
Амины встречаются в природе. Они имеют запах испорченной рыбы. Применяют амины для синтеза лекарств, пластмасс.
Наибольшее распространение из аминов получил анилин. Он идёт на производство красителей, взрывчатых веществ, фотоматериалов, лекарственных препаратов.
Упражнение 2
Решите задачу: при сгорании органического соединения массой 3,1 образовалось 2,24 л углекислого газа, 1,12 л азота и 4,5 г воды. Составьте структурную формулу данного вещества.
Упражнение 3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: этанол → бромэтан → этиламин → хлорид этиламмония.
Формулы веществ записывайте структурно.
Контрольные вопросы
1. Почему амины относят к органическим основаниям?
2. Какие химические свойства характерны для анилина? Почему у него основные свойства слабее аммиака?
3. Как получают амины по реакции Зинина?
4. Укажите области применения анилина.
Ответы
Упражнение 1
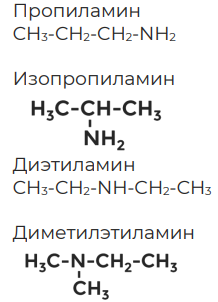
Упражнение 2
Ответ: .
Упражнение 3
этанол → бромэтан → этиламин → хлорид этиламмония

