- Строение ɑ-аминокислот. Номенклатура
- Физические свойства аминокислот
- Химические свойства аминокислот
- Качественные реакции на белки. Денатурация белка
- Получение аминокислот
- Применение аминокислот. Белки
- рассмотреть особенности строения ɑ-аминокислот
- научиться составлять уравнения химических реакций с участием аминокислот
- рассмотреть качественные реакции на белки
- рассмотреть основные способы получения аминокислот
- рассмотреть применение аминокислот и белков
- Как классифицируют амины?
- Какие реакции характерны для аминов?
- Какие реакции характерны для карбоновых кислот?
- Между какими веществами и при каких условиях протекает реакция этерификации?
Строение ɑ-аминокислот. Номенклатура
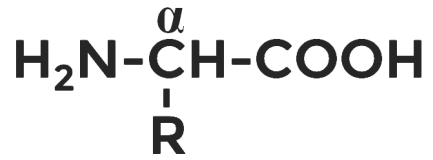
Аминокислоты всегда содержат аминогруппу и карбоксильную группу. Особое значение имеют α-аминокислоты , у которых аминогруппа и карбоксильная группа разделены одним атомом углерода.
Общая формула таких соединений будет выглядеть следующим образом.
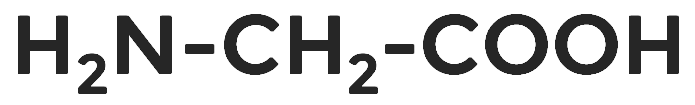
В качестве примеров можно привести такие аминокислоты, как аминоуксусная кислота, или глицин.
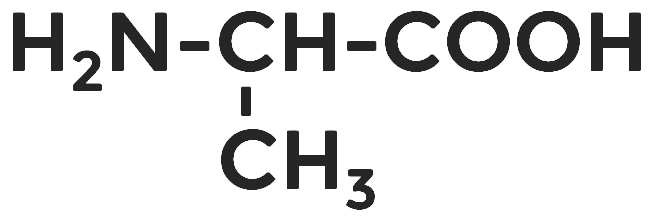
Аминопропионовая, или аланин.
Фенилаланин, ароматическая аминокислота.
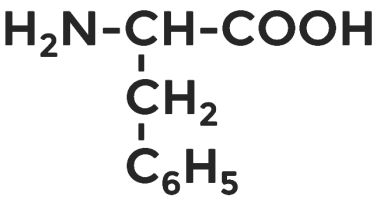
Известно около 500 аминокислот, но только 20 из них участвуют в построении белков.
Аминокислоты — органические соединения, в молекуле которых одновременно содержатся карбоксильные и амино группы.
Физические свойства аминокислот
Аминокислоты — кристаллические вещества, хорошо растворимые в воде. Они могут быть сладкими, безвкусными и даже горькими.
Вещества обладают как кислотными, так и основными свойствами, поэтому окраска индикаторов в их растворах не меняется.
Химические свойства аминокислот
Как вы наверняка догадались, для аминокислот будут типичны свойства как карбоновых кислот, так и аминов (основные свойства). Следовательно, у них будут проявляться амфотерные свойства . Рассмотрим подробнее типичные реакции аминокислот.
Реакции аминокислот по карбоксильной группе
Наличие карбоксильной группы в составе обусловливает кислотные свойства. Поэтому они вступают в реакции с металлами, оксидами металлов, основаниями, вытесняют более слабые кислоты из солей.
Так, аминокислоты реагируют со щелочами, образуя соли:
.
аминоацетат натрия
(глицинат натрия)
Вступают в реакцию с активными металлами:
.
аминоацетат калия
(глицинат калия)
С солями слабых кислот, например, с карбонатами:
аминопропионат натрия
Наряду с карбоновыми кислотами аминокислоты вступают в реакцию этерификации со спиртами:
.
метиловый эфир
аминоуксусной кислоты (метиламиноацетат)
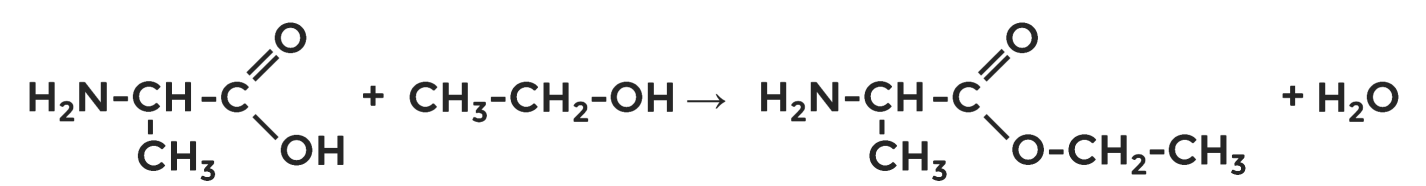
этиловый эфир
аминопропионовой кислоты
(этиламинопропионат)
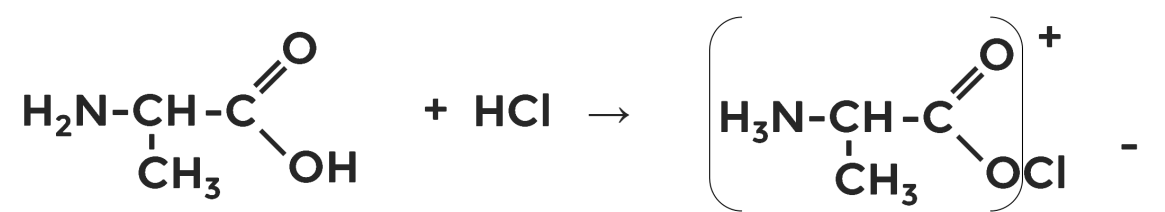
Реакции аминокислот по аминогруппе
Наличие аминогруппы определяет основные свойства аминокислот. Поэтому они реагируют с кислотами, образуя соответствующие средние (первая реакция) и кислые (вторая реакция) соли:
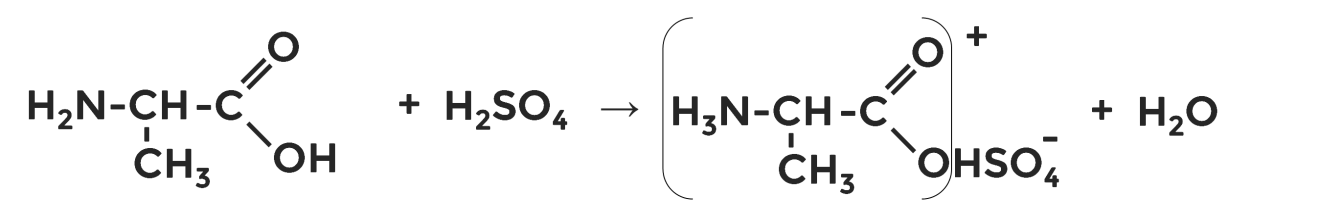
Образование пептидов
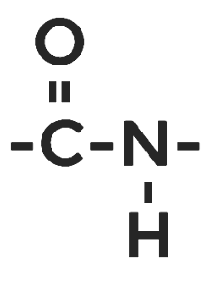
Наличие кислотных и основных групп у аминокислот даёт возможность взаимодействовать им друг с другом. В результате образуются полипептиды , состоящие из остатков аминокислот, а связь между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой получила название пептидной .
В качестве примера можно привести уравнение образования дипептида из аланина и глицина.
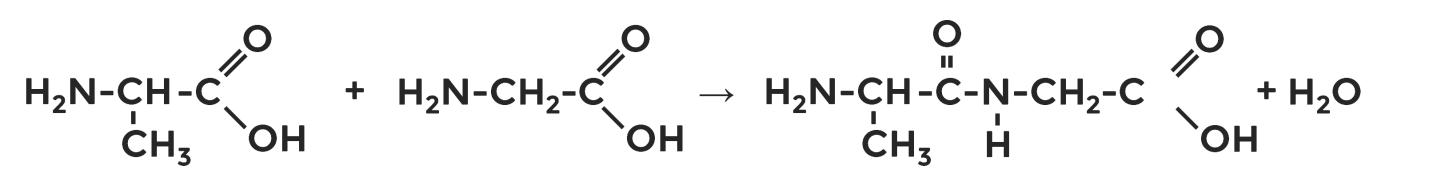
В нашем примере это дипептид .
В природе же существуют полипептиды, содержащие до 50 остатков аминокислот.
В процессе их образования выделяется вода, поэтому реакция относится к поликонденсации.
Горение аминокислот
Аминокислоты горят. В результате выделяется углекислый газ, вода и молекула азота.
Качественные реакции на белки. Денатурация белка
Полипептиды отличаются от белков количеством аминокислотных остатков. В белках их более 50, в то время как в полипептидах меньше.
Белки — природные полимеры, состоящие из остатков аминокислот, связанных пептидными связями.
Белки могут иметь 4 структуры :
- линейная последовательность аминокислот в белке называется первичной структурой ;
- вторичная структура образуется за счёт внутримолекулярных водородных связей; полипептид закручивается в спираль;
- третичная структура характеризуется упаковкой спирали в клубок;
- четвертичная структура у сложных белков представляет собой глобулу.
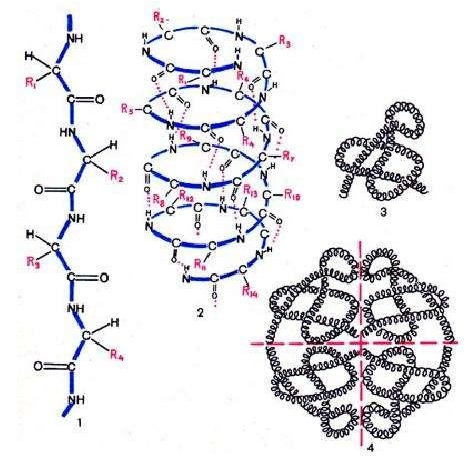 Рисунок 1. Структуры белков
Рисунок 1. Структуры белков
Белки могут утратить свою структуру. Такое явление называется денатурацией белка . Обратный процесс (ренатурация) протекает, если денатурация произошла незначительно и белок возвращается к начальной структуре.
Денатурация — изменение белковой молекулы под действием различных факторов.
 Рисунок 2. Денатурация белка куриного яйца под действием температуры
Рисунок 2. Денатурация белка куриного яйца под действием температуры
К денатурации белков приводят: соли тяжёлых металлов, сильные кислоты и щёлочи, этиловый спирт, высокая или низкая температура, воздействие всех видов излучения, например радиоактивного.
Для живых организмов денатурация белков губительна, однако она необходима в промышленности, особенно в пищевой. Например для приготовления пищи.
 Рисунок 3. Денатурация белка куриного яйца под действием этанола
Рисунок 3. Денатурация белка куриного яйца под действием этанола
Самый простой пример — приготовление яичницы, где мы наблюдаем денатурацию белка куриного яйца от термического воздействия.
Куда более опасно действие некоторых реагентов, например этилового спирта. Тоже самое происходит со слизистыми оболочками, когда человек выпивает алкогольные напитки.
 Рисунок 4. Биуретовая реакция на белки
Рисунок 4. Биуретовая реакция на белки
Белки можно определить с помощью характерных качественных реакций. Это так называемые «цветные реакции на белки» .
Дело в том, что с гидроксидом меди они образуют раствор фиолетового цвета. Эта реакция получила название «биуретовой» .
 Рисунок 5. Ксантопротеиновая реакция на белки
Рисунок 5. Ксантопротеиновая реакция на белки
Белки, содержащие аминокислотные остатки с ароматическими радикалами, дают «ксантопротеиновую реакцию». Под действием концентрированной азотной кислоты образуется характерное жёлтое окрашивание, которое становится оранжевым при добавлении аммиака.
Получение аминокислот
В промышленности аминокислоты получают гидролизом белков.
Также аминокислоты возможно получить галогенированием карбоновых кислот с последующим добавлением аммиака.
хлоруксусная кислота
аминоуксусная кислота
Применение аминокислот. Белки
В природе существует около 500 аминокислот, из которых 20 являются основными.
Они подразделяются на незаменимые и заменимые аминокислоты. Незаменимыми аминокислотами являются те, синтез которых человеческим организмом не предусмотрен (рис. 6).
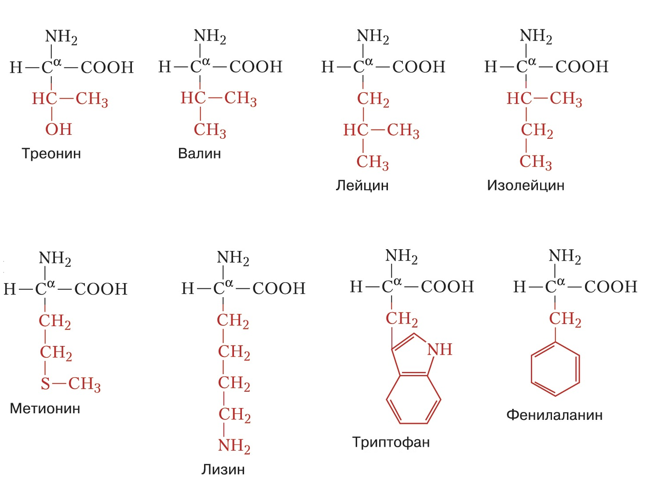 Рисунок 6. Незаменимые аминокислоты
Рисунок 6. Незаменимые аминокислоты
Заменимыми аминокислотами являются те, которые попадают в организм человека вместе с продуктами питания (рис. 7.1 и 7.2).
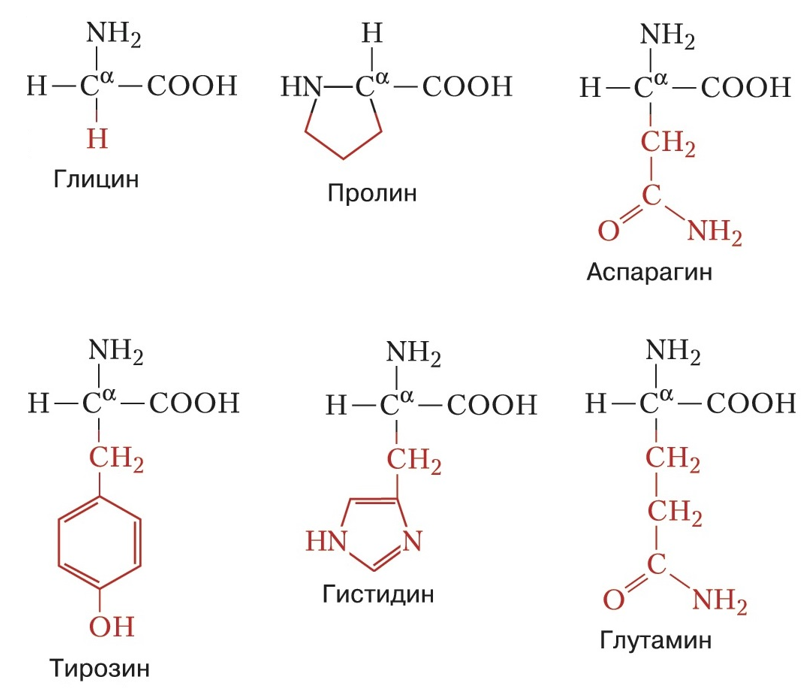 Рисунок 7.1. Заменимые аминокислоты
Рисунок 7.1. Заменимые аминокислоты
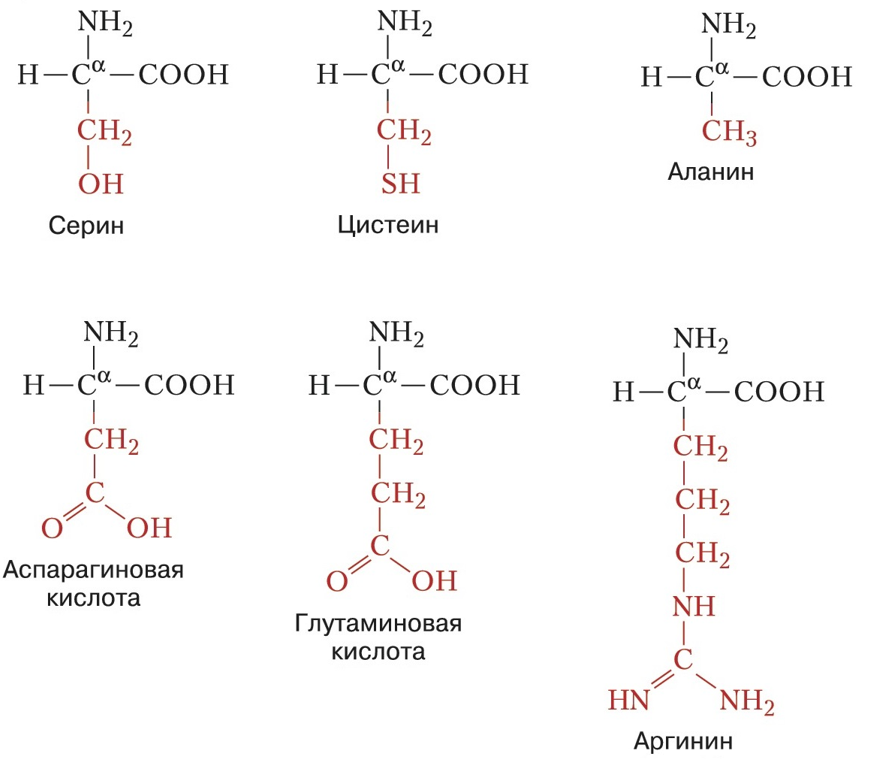 Рисунок 7.2. Заменимые аминокислоты
Рисунок 7.2. Заменимые аминокислоты
Белки необходимы всем веществам на Земле как строительный материал клеток. Попадая в организм, они подвергаются гидролизу под действием ферментов. В результате образуются отдельные аминокислоты, из которых создаются белки, присущие данному организму. Это необходимо учитывать людям, отказывающимся от белковой пищи по тем или иным соображениям. Помимо этого аминокислоты и белки используются в сельском хозяйстве, медицине.
Так, например, для известного волокна капрон применяется 6-аминогексановая кислота (-аминокапроновая): .
Упражнение 1
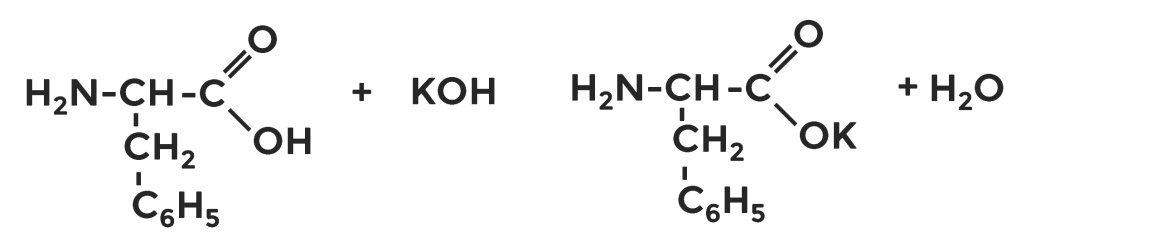
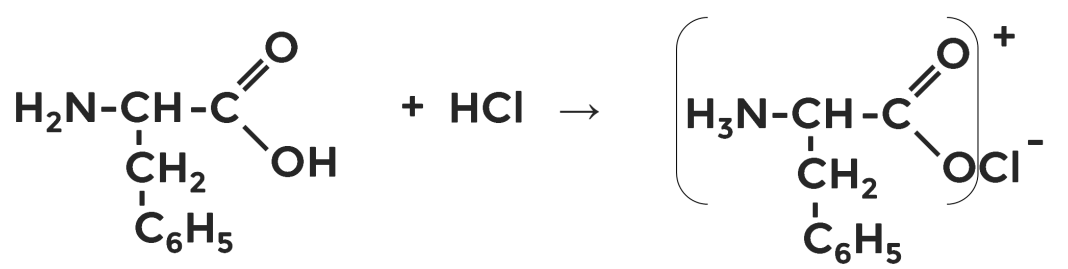
Составьте уравнения химических реакций, доказывающие кислотные и основные свойства фенилаланина.
Упражнение 2
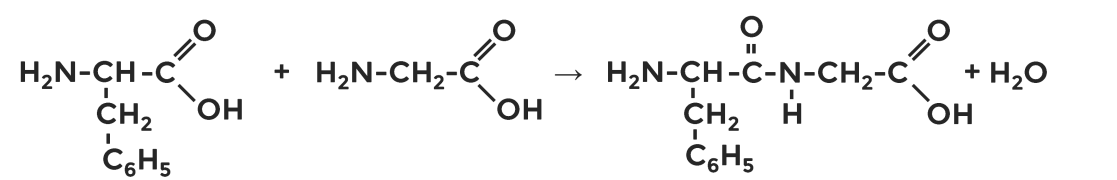
Составьте уравнение химической реакции получения дипептида из глицина и фенилаланина. Формулы веществ записывайте структурно.
Упражнение 3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: пропионовая кислота → 2-бромпропановая кислота → аланин → гидрохлорид аланина.
Формулы веществ записывайте структурно.
Контрольные вопросы
1. Почему аминокислоты являются амфотерными органическими соединениями?
2. Какие химические свойства характерны для аминокислот? Как образуются полипептиды?
3. Как получают аминокислоты?
4. Что такое денатурация белка? Какие факторы влияют на этот процесс?
5. Какие вы знаете качественные (цветные) реакции на белки?
6. Укажите области применения аминокислот.
Ответы
Упражнение 1
Примерные варианты уравнений химических реакций.
А) кислотные свойства
Б) основные свойства
Упражнение 2
Упражнение 3
пропионовая кислота → 2-бромпропановая кислота → аланин → гидрохлорид аланина