- ПСХЭ Д. И. Менделеева и строение атома
- Строение вещества и химическая связь
- Основные классы неорганических веществ
- повторить основные понятия по теме «Строение атома»
- обобщить и систематизировать знания о строении вещества и химической связи
- охарактеризовать основные классы неорганических веществ
- Сколько различных видов атомов известно на данный момент?
- Перечислите известные вам виды химической связи.
- Что такое электроотрицательность элемента?
Периодическая система химических элементов и строение атома
 Рисунок 1. Модель атома гелия
Рисунок 1. Модель атома гелия
Вспомним строение атома.
В ядре атома находятся протоны и нейтроны. Соотношение числа протонов и нейтронов определяется уравнением:
,
где A — массовое число; N — число нейтронов в ядре; Z — число протонов.
Ядро окружено электронной оболочкой с электронами, которые располагаются на электронных слоях (энергетических уровнях).
Положение элемента в ПСХЭ Д. И. Менделеева определяется строением его атома:
- число протонов в ядре и число электронов — атомный номер элемента;
- число энергетических уровней в электронной оболочке — номер периода;
- число валентных электронов, то есть электронов на внешнем энергетическом уровне — номер группы.
Свойства элементов, а также свойства образуемых ими соединений, изменяются с некоторой периодичностью, которую можно отследить благодаря периодической системе.
|
№
|
Свойства
|
По периоду слева направо
|
По группе сверху вниз
|
|
1
|
Радиус атома
|
уменьшается
|
увеличивается
|
|
2
|
Заряд ядра (количество протонов)
|
увеличивается
|
увеличивается
|
|
3
|
Металлические свойства
|
ослабляются
|
усиливаются
|
|
4
|
Неметаллические свойства
|
усиливаются
|
ослабляются
|
|
5
|
Восстановительные свойства
|
ослабляются
|
усиливаются
|
|
6
|
Окислительные свойства
|
усиливаются
|
ослабляются
|
|
7
|
Основные свойства оксидов и гидроксидов
|
ослабляются, переходя в амфотерные
|
усиливаются
|
|
8
|
Кислотные свойства оксидов и гидроксидов
|
усиливаются
|
ослабевают
|
|
9
|
Количество энергетических уровней
|
не изменяются
|
увеличивается
|
|
10
|
Валентность (число валентных электронов)
|
увеличивается
|
не изменяется
|
|
11
|
Высшая степень окисления
|
увеличивается
|
не изменяется
|
|
12
|
Низшая степень окисления
|
увеличивается от −4 до −1 (IV–VII группы)
|
не изменяется
|
|
13
|
Электроотрицательность
|
увеличивается
|
уменьшается
|
|
14
|
Радиус атома
|
уменьшается
|
увеличивается
|
Упражнение 1
Дайте полную характеристику серы по положению в ПСХЭ Д. И. Менделеева.
Строение вещества. Химическая связь
Химическая связь — это взаимодействие атомов, осуществляемое путём обмена электронами или их перехода от одного атома к другому.
Мы говорили об ионной, ковалентной и металлической связи. Для определения типа химической связи в простых веществах и бинарных соединениях можно воспользоваться схемой:
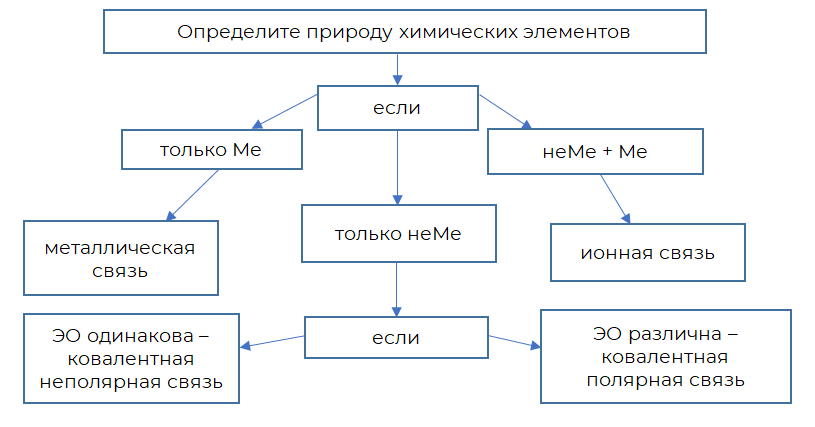
В данной схеме: неМе — неметалл; Ме — металл; ЭО — электроотрицательность элемента.
Самый электроотрицательный элемент — фтор. По нему можно ориентироваться при определении степени окисления других элементов: чем дальше химический элемент от фтора, тем меньше его электроотрицательность.
Важной величиной является степень окисления.
Степень окисления — условный заряд атома химического элемента.
Для расчёта степени окисления нужно помнить несколько правил:
- Водород в сложных веществах имеет степень окисления +1 (кроме гидридов, в которых его степень окисления равна −1, например, в гидриде натрия );
- Кислород в сложных веществах имеет степень окисления −2 (кроме пероксидов, в них его степень окисления −1, и кроме фторидов, где его степень окисления +2 или +1);
- Максимальная (высшая) степень окисления металлов равна номеру группы;
- Минимальная (низшая) степень окисления неметаллов (кроме водорода) равна номеру группы минус восемь;
- Сумма степеней окисления всех атомов в соединении равна нулю,
а в ионе — заряду иона; - Степень окисления атомов в простых веществах равна нулю;
- В кислородсодержащей кислоте центральный атом имеет такую же степень окисления, как и во всех солях данной кислоты (например, в серной кислоте и сульфатах сера всегда будет иметь степень окисления +6).
Упражнение 2
Определите тип химической связи и степени окисления элементов в следующих соединениях:
- бромид калия;
- азотная кислота;
- йод;
- медь;
- сероводород;
- фосфат кальция.
Основные классы неорганических веществ
Приведём схему классификации неорганических веществ.
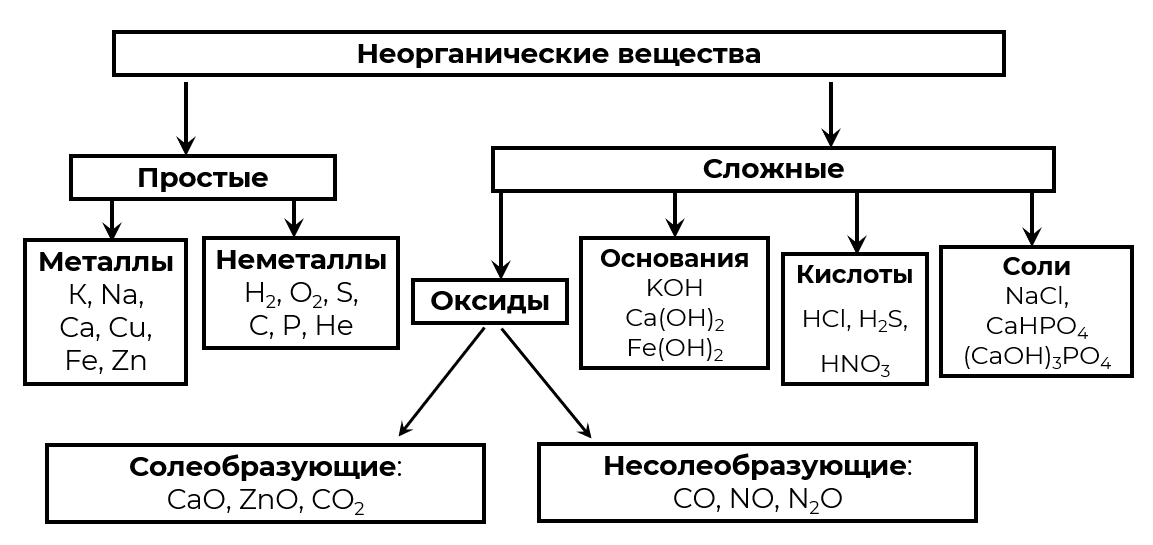
Упражнение 3
Определите, к какому классу относятся вещества:
- фтор;
- гидрофосфат натрия;
- азотистая кислота;
- гидроксид меди (II);
- оксид хрома (VI);
- золото;
- белый фосфор;
- хлорид серебра.
Контрольные вопросы
- Как определить число протонов и электронов в атоме химического элемента?
- Что такое химическая связь? Какие виды химической связи вы знаете и как его определить?
- Перечислите основные классы неорганических соединений.

