- Общие сведения об органической химии
- Предельные углеводороды
- Непредельные углеводороды
- познакомиться с общими сведениями о предельных и непредельных углеводородах
- Какие степени окисления способен проявлять углерод в соединениях? А какую валентность?
- Приведите примеры известных вам соединений углерода.
Атомы углерода — важнейшая составляющая всех природных органических веществ, например, белков, жиров, углеводов. Органические вещества изучает особый раздел химии — органическая химия. Органическую химию ещё называют химией соединений углерода. Она не изучает аллотропные модификации углерода, его оксиды, карбиды, угольную кислоту и её соли. Данные соединения углерода относятся к неорганической химии.
Конечно, органическая и неорганическая химия имеет лишь условную границу. Эти науки тесно взаимосвязаны. Так, из неорганических веществ можно получить органические, например, при гидролизе карбида алюминия образуется органическое вещество — метан:
.
Метан — углеводород.
Углеводороды — органические соединения, состоящие из атомов углерода и водорода.
Метан — простейший углеводород. Углерод в нём, как и во всех органических соединениях, четырёхвалентен.
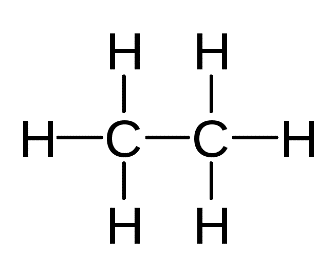
Ещё один представитель углеводородов — этан . Два атома углерода в молекуле этана связаны между собой одной электронной парой, то есть одной ковалентной связью. У каждого атома углерода остаётся ещё по три электрона, которые они расходуют на образование связи с атомом водорода.
В органической химии принято отображать структурные формулы веществ, то есть формулы, в которых отображается порядок соединения атомов в молекуле. Валентными штрихами обозначаются связи между атомами.
По структурной формуле можно легко определить валентность каждого атома. Сколько связей образует атом, такова и его валентность. Валентность углерода в органических соединениях всегда равна четырём, а водорода — одному. Важно отметить, что степень окисления углерода не всегда будет совпадать с валентностью:
.
В подобных соединениях содержится максимальное количество атомов водорода, поэтому их называют предельными, или насыщенными.
Структура, строение самого вещества имеет большое значение для органической химии, в связи с этим молекулярные формулы, отражающие только качественный (какие элементы входят в состав вещества) и количественный (сколько атомов каждого элемента входит в состав его молекулы) состав вещества, малоинформативны. Минус структурных формул в том, что они достаточно объёмные. Поэтому чаще всего используются сокращённые структурные формулы. В них показываются только связи между атомами углерода, а изображение атомов водорода «сворачивают».
Пример 1
Запишите сокращённую структурную формулу пропана .
Решение
1. В молекуле пропана три атома углерода, которые соединены между собой одинарными связями.
2. Углеродный скелет будет выглядеть следующим образом:
.
3. Углерод в органических веществах всегда четырёхвалентен, то есть образует четыре связи с другими атомами. У первого атома углерода остаётся ещё три свободные связи, у второго — две, у третьего — три. Нужно дополнить формулу атомами водорода.
4. Составим сокращённую структурную формулу пропана:
.
Упражнение 1
Запишите сокращённую структурную формулу бутана .
Реакция горения является одной из важнейших в органической химии.
Предельные углеводороды хорошо горят с выделением большого количества теплоты:
.
Также для них характерна реакция дегидрирования — реакция отщепления водорода. Например, каждый атом углерода в молекуле этана теряет по одному атому водорода. У каждого атома углерода остаётся по одной свободной валентности. И данные атомы углерода образуют ещё одну связь друг с другом:
.
Чтобы не перепутать двойную связь со знаком равенства, в уравнениях реакций вместо знака равно ставят стрелку.
Упражнение 2
Запишите уравнение реакции дегидрирования пропана.
В реакциях дегидрирования образуются углеводороды с двойными или тройными связями между атомами углерода. Такие соединения называют непредельными, или ненасыщенными, так как в них валентности атомов углерода не насыщены по максимуму атомами водорода.
При дегидрировании этана образуется этилен — углеводород с двойной углерод-углеродной связью. Если от каждого атома углерода в этилене отщепить ещё по одному атому водорода, то образуется ацетилен — непредельный углеводород с тройной углерод-углеродной связью:
.
Водородных соединений углерода огромное количество. Дело в том, что атомы углерода обладают уникальной способностью образовывать друг с другом цепочки различной длины, разветвлённые цепи и могут связываться между собой одинарными, двойными или тройными связями. Это всего лишь одна из причин многообразия органических веществ, которые сейчас насчитывается более 100 млн.
Контрольные вопросы
- Что изучает органическая химия? Какие соединения она не изучает?
- Какова валентность атома углерода в органических соединениях?
- Всегда ли в органических соединениях степень окисления углерода и его валентность совпадают?
- Приведите примеры предельных и непредельных углеводородов.

