- Открытие протона и нейтрона. Зарядовое и массовое число
- знать понятия: зарядовое и массовое число, нуклон, изотоп; частицы, входящие в состав атома
- уметь находить количество протонов, нейтронов и электронов, входящих в атом
- Опишите модель атома, предложенную Резерфордом.
- Как заряжено ядро атома?
- Какую модель атома ввёл Томсон?
Открытие протона и нейтрона. Зарядовое и массовое числа
Резерфорд установил, что весь положительный заряд и практически вся масса атома сосредоточены в ядре. Было известно, что массы атомов всех химических элементов кратны массе атома водорода, поэтому учёный предположил, что в состав ядра любого атома входят ядра водорода. В ходе экспериментов Резерфорд установил, что при воздействии альфа-излучением на ядра азота из атома выбивается положительно заряженная частица, которую физик назвал протоном.
Протон — это положительно заряженная частица, входящая в состав ядра.
В электрически нейтральном атоме количество протонов равно количеству электронов.
Масса протона составляет mp ≈ 1,673 ∙ 10-27 кг, что примерно в 1 800 раз больше массы электрона, заряд протона по модулю равен заряду электрона.
Вскоре после открытия Резерфордом протона было установлено, что протон является ядром атома водорода.
Порядок элементов в Периодической системе химических элементов, составленной Дмитрием Ивановичем Менделеевым (1834–1907), соответствует порядку возрастания количества протонов в ядре (порядку возрастания заряда ядра).
Количество протонов в атомном ядре химического элемента называется зарядовым числом Z этого ядра.
Так, зарядовое число водорода Z = 1, заряд ядра плутония Z = 94.
Глядя на таблицу Менделеева нетрудно убедиться, что у всех химических элементов, кроме водорода, атомная масса ядер элементов отличается от общей массы протонов, входящих в атом. Так, масса ядра плутония равна 244, а количество протонов в ядре равно 94. Очевидно, что в состав ядра должны входить электрически нейтральные частицы с массами, близкими к массе протона.
Путём бомбардирования атомов азота протонами английскому физику Джеймсу Чедвику (1891–1974) удалось открыть новую частицу, на которую не оказывали влияние ни магнитное, ни электрическое поля.
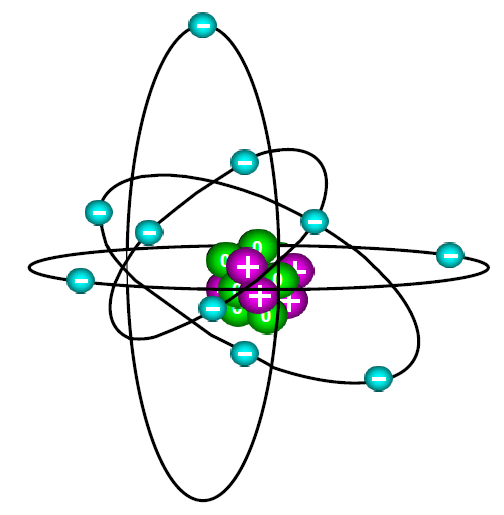 Рис. 1. Современное предоставление о строении атома
Рис. 1. Современное предоставление о строении атома
Так была открыта электрически нейтральная частица – нейтрон.
Масса нейтрона составляет mn ≈ 1,675 ∙ 10-27 кг, что практически равно массе протона.
После открытия нейтрона двое учёных — Дмитрий Дмитриевич Иваненко (1904–1994) и Вернер Гейзенберг (1901–1976) — независимо друг от друга предложили модель атома, согласно которой ядро атома состояло из протонов и нейтронов, а вокруг ядра по орбиталям вращались электроны (рис. 1).
Ядро атома состоит из протонов и нейтронов, эти частицы называют нуклонами.
Общее количество нуклонов в ядре называется массовым числом этого ядра A.
Пусть количество нейтронов в ядре атома равно N, тогда массовое число представляет собой сумму количества нейтронов и зарядового числа:
.
Существуют атомы одного и того же химического элемента, содержащие равное количество протонов, но разное количество нейтронов. Такие атомы называются изотопами.
Изотопы имеют разные массовые числа, но благодаря равному количеству протонов имеют одинаковые химические свойства.
Изотопы принято обозначать символом элемента из таблицы Менделеева с двумя индексами: верхний индекс обозначает массовое число, нижний — заряд ядра:
. Например, изотоп титана обозначается .
В природе встречается три вида изотопов водорода: протий , дейтерий и тритий , содержащие 0, 1 и 2 нейтрона соответственно.
Рассмотрим состав нейтрального изотопа урана . Данный изотоп содержит 92 протона, 92 электрона, заряд ядра равен Z = 92, количество нейтронов равно
.
Резерфорд обнаружил протон путём бомбардировки азота альфа-частицей. Запишем реакцию, описывающую процесс, используя введённые обозначения:
.
Итоги
- Протон — это положительно заряженная частица, входящая в состав ядра.
- В электрически нейтральном атоме количество протонов равно количеству электронов.
- Количество протонов в атомном ядре химического элемента называется зарядовым числом Z этого ядра.
- Ядро атома состоит из протонов и нейтронов, эти частицы называют нуклонами. Общее количество нуклонов в ядре называется массовым числом этого ядра A.
- Массовое число представляет собой сумму количества нейтронов и зарядового числа: .
Контрольные вопросы
1. Какие атомы называются изотопами?
2. Что такое массовое число ядра атома?
3. Сколько протонов, нейтронов и электронов в нейтральном атоме фосфора ?
- Открытие протона и нейтрона. Зарядовое и массовое число
- знать понятия: зарядовое и массовое число, нуклон, изотоп; частицы, входящие в состав атома
- уметь находить количество протонов, нейтронов и электронов, входящих в атом
- Опишите модель атома, предложенную Резерфордом.
- Как заряжено ядро атома?
- Какую модель атома ввёл Томсон?
Открытие протона и нейтрона. Зарядовое и массовое числа
Резерфорд установил, что весь положительный заряд и практически вся масса атома сосредоточены в ядре. Было известно, что массы атомов всех химических элементов кратны массе атома водорода, поэтому учёный предположил, что в состав ядра любого атома входят ядра водорода. В ходе экспериментов Резерфорд установил, что при воздействии альфа-излучением на ядра азота из атома выбивается положительно заряженная частица, которую физик назвал протоном.
Протон — это положительно заряженная частица, входящая в состав ядра.
В электрически нейтральном атоме количество протонов равно количеству электронов.
Масса протона составляет mp ≈ 1,673 ∙ 10-27 кг, что примерно в 1 800 раз больше массы электрона, заряд протона по модулю равен заряду электрона.
Вскоре после открытия Резерфордом протона было установлено, что протон является ядром атома водорода.
Порядок элементов в Периодической системе химических элементов, составленной Дмитрием Ивановичем Менделеевым (1834–1907), соответствует порядку возрастания количества протонов в ядре (порядку возрастания заряда ядра).
Количество протонов в атомном ядре химического элемента называется зарядовым числом Z этого ядра.
Так, зарядовое число водорода Z = 1, заряд ядра плутония Z = 94.
Глядя на таблицу Менделеева нетрудно убедиться, что у всех химических элементов, кроме водорода, атомная масса ядер элементов отличается от общей массы протонов, входящих в атом. Так, масса ядра плутония равна 244, а количество протонов в ядре равно 94. Очевидно, что в состав ядра должны входить электрически нейтральные частицы с массами, близкими к массе протона.
Путём бомбардирования атомов азота протонами английскому физику Джеймсу Чедвику (1891–1974) удалось открыть новую частицу, на которую не оказывали влияние ни магнитное, ни электрическое поля.
 Рис. 1. Современное предоставление о строении атома
Рис. 1. Современное предоставление о строении атома
Так была открыта электрически нейтральная частица – нейтрон.
Масса нейтрона составляет mn ≈ 1,675 ∙ 10-27 кг, что практически равно массе протона.
После открытия нейтрона двое учёных — Дмитрий Дмитриевич Иваненко (1904–1994) и Вернер Гейзенберг (1901–1976) — независимо друг от друга предложили модель атома, согласно которой ядро атома состояло из протонов и нейтронов, а вокруг ядра по орбиталям вращались электроны (рис. 1).
Ядро атома состоит из протонов и нейтронов, эти частицы называют нуклонами.
Общее количество нуклонов в ядре называется массовым числом этого ядра A.
Пусть количество нейтронов в ядре атома равно N, тогда массовое число представляет собой сумму количества нейтронов и зарядового числа:
.
Существуют атомы одного и того же химического элемента, содержащие равное количество протонов, но разное количество нейтронов. Такие атомы называются изотопами.
Изотопы имеют разные массовые числа, но благодаря равному количеству протонов имеют одинаковые химические свойства.
Изотопы принято обозначать символом элемента из таблицы Менделеева с двумя индексами: верхний индекс обозначает массовое число, нижний — заряд ядра:
. Например, изотоп титана обозначается .
В природе встречается три вида изотопов водорода: протий , дейтерий и тритий , содержащие 0, 1 и 2 нейтрона соответственно.
Рассмотрим состав нейтрального изотопа урана . Данный изотоп содержит 92 протона, 92 электрона, заряд ядра равен Z = 92, количество нейтронов равно
.
Резерфорд обнаружил протон путём бомбардировки азота альфа-частицей. Запишем реакцию, описывающую процесс, используя введённые обозначения:
.
Итоги
- Протон — это положительно заряженная частица, входящая в состав ядра.
- В электрически нейтральном атоме количество протонов равно количеству электронов.
- Количество протонов в атомном ядре химического элемента называется зарядовым числом Z этого ядра.
- Ядро атома состоит из протонов и нейтронов, эти частицы называют нуклонами. Общее количество нуклонов в ядре называется массовым числом этого ядра A.
- Массовое число представляет собой сумму количества нейтронов и зарядового числа: .
Контрольные вопросы
1. Какие атомы называются изотопами?
2. Что такое массовое число ядра атома?
3. Сколько протонов, нейтронов и электронов в нейтральном атоме фосфора ?



