- Аммиак в промышленности
- Физические свойства аммиака
- Химические свойства аммиака
- Производство аммиака
- Физические свойства метанола
- Химические свойства метанола
- Производство метанола
- понимать, чем обусловлены физические и химические свойства аммиака и метанола
- знать особенности химических реакций аммиака и метанола
- знать технологию производства аммиака и метанола
- знать для чего применяется химическая технология
В условиях постоянного развития науки и промышленности химия и химическая технология предлагают миру постоянные инновации. Как правило, их суть заключается в совершенствовании методов переработки сырья в предметы потребления, а также средства производства. Происходит это благодаря целому ряду процессов.
Новые химические технологии позволяют:
- вводить в хозяйственную деятельность новые виды сырья и материалов;
- перерабатывать абсолютно все виды сырья;
- заменять дорогостоящие компоненты более дешёвыми аналогами;
- комплексно использовать материалы: получать из одного вида сырья разные продукты и наоборот;
- внедрять вторичную переработку.
Наука, рассматривающая наиболее экономичные, а также экологически обоснованные методы химической переработки сырых природных материалов в предметы потребления и средства производства, носит название химическая технология.
Химические технологии можно классифицировать по типам веществ, с которыми ведётся работа: органическими и неорганическими.
Химическая технология неорганических веществ — это, например, производство кислот, соды, щелочей, силикатов, минеральных удобрений и солей. Все эти продукты широко используются в разных отраслях промышленности, в частности металлургии, а также в сельском хозяйстве.
В фармацевтике и машиностроении часто используют каучуки, спирт, пластмассы, различные красители. Их производством занимаются предприятия, использующие технологии получения органических веществ.
Аммиак в промышленности
Азотное производство играет важнейшую роль в современной химической промышленности. Стоит заметить, что соединения азота применяются как при получении органических, так и неорганических веществ. Особую статью в азотной промышленности составляет производство аммиака. Именно при «участии» этого ценнейшего компонента производятся удобрения, азотная кислота, взрывчатые вещества, хладагенты и многое другое.
Физические свойства аммиака
При всей своей полезности аммиак является довольно сильным ядом, несмотря на то что применяется в медицине в виде нашатыря.
Аммиак — бесцветный газ с резким удушливым характерным запахом.
Аммиак — ядовитое соединение. Аммиачные пары раздражают слизистую оболочку глаза и кожные покровы. В результате происходит обильное выделение слёз и боль в области лица. Появляется ожог роговицы глаза. Зрение человека ухудшается или происходит полная его потеря. Следом наступает приступ кашля, изменение цвета кожного покрова с сильным раздражением.
При попадании в область дыхательных путей способен токсинами поразить лёгкие и вызвать отёк с поражением разных систем живого организма.
Молекулярная формула аммиака Он имеет резкий запах (нашатырного спирта), легче воздуха, хорошо растворим в воде.
Химические свойства аммиака
В химическом отношении аммиак довольно активен: он вступает в реакции взаимодействия со многими веществами. Степень окисления азота в аммиаке
«−3» — минимальная, поэтому аммиак проявляет только восстановительные свойства. При нагревании аммиака с галогенами, оксидами тяжёлых металлов и кислородом образуется азот.
Пример 1
Написать реакцию между аммиаком и хлором.
Решение
1. Запишем реакцию между аммиаком и хлором:
.
2. Запишем окислительно-восстановительный процесс этой реакции:
6 1 восстановитель,
6
2 3 окислитель.
3. Расставим коэффициенты: .
Аналогично будет идти реакция с оксидами металлов:
.
А также с кислородом (реакция горения) без участия катализатора:
.
Если же в реакции с кислородом участвует катализатор (Pt), то вместо аммиака будет выделяться другой газ — оксид азота (II):
.
Аммиак не проявляет кислотные свойства. Однако атомы водорода в его молекуле всё же способны замещаться на атомы металлов. При полном замещении водорода металлом происходит образование соединений, называемых нитридами, которые также можно получить и при непосредственном взаимодействии азота с металлом при высокой температуре.
Производство аммиака
Процесс производства аммиака характеризуется большой энергоёмкостью, что является главным его недостатком. Именно поэтому постоянно ведутся научные разработки, которые призваны решить проблемы экономии энергии. В настоящее время разрабатываются способы утилизации выделенной энергии, а также совмещение, например производства аммиака и карбамида. Всё это способствует удешевлению деятельности предприятий и повышению их полезной отдачи.
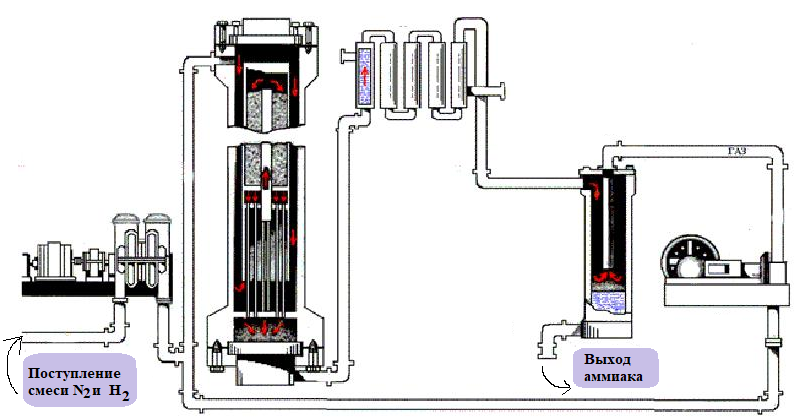
В основу производства аммиака положены принцип циркуляции, согласно которому процесс идёт непрерывно, причём остатки исходных компонентов отделяются от конечного продукта и используются вновь, непрерывно: процесс синтеза происходит без остановки, принцип теплообмена, а также принцип цикличности. Как видно, все эти принципы между собой тесно взаимосвязаны.
Синтез аммиака строится из взаимодействия простых веществ — водорода и азота.
Пример 2
Написать уравнение реакции образования аммиака.
Решение
1. Запишем реакцию между водородом и азотом:
.
2. Запишем окислительно-восстановительный процесс этой реакции:
2 3 восстановитель,
6
6 1 окислитель.
3. Расставим коэффициенты: .
Применение аммиака
Производство аммиака — один из важнейших технологических процессов во всем мире. Ежегодно в мире производят около 100 млн т аммиака. Выпуск аммиака осуществляют в жидком виде или в виде 25%-го водного раствора — аммиачной воды.
Основные направления использования аммиака: производство азотной кислоты (производство азотсодержащих минеральных удобрений в последствии), солей аммония, мочевины, уротропина, синтетических волокон (нейлона и капрона). Аммиак применяют в качестве хладагента в промышленных холодильных установках, в качестве отбеливателя при очистке и крашении хлопка, шерсти и шёлка.
Физические свойства метанола
Метанол — это химическое вещество, которое называется древесным или метиловым спиртом. Его получение не является сложным процессом, поскольку он относится к одноатомным продуктам. Использование данного спирта в алкогольных напитках может привести к пищевому отравлению. Метанол также может образовывать взрывоопасные смеси при температуре 8 градусов по Цельсию.
Метиловый спирт является простейшим одноатомным спиртом, является первым представителем гомологического ряда. Данный спирт представляет собой жидкость, смешивающуюся с водой в любых пропорциях.
Химические свойства метанола
Метанол — неэлектролит, соответственно, в водном растворе не диссоциирует на ионы. Также данное соединение не проявляет кислотные свойства, у него они выражены даже слабее, чем у воды.
Взаимодействие с активными металлами
Метанол не взаимодействует с растворами щелочей, так как образующиеся алкоголяты почти полностью гидролизуются водой. Зато соединение вступает в реакцию с активными металлами. При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
Пример 3
Написать реакцию образования метилата натрия.
Решение
1. Запишем реакцию между метиловым спиртом и натрием:
.
2. Запишем окислительно-восстановительный процесс этой реакции:
2 1 окислитель,
2
1 2 восстановитель.
3. Расставим коэффициенты: .
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла. Так, например, метилат калия разлагается водой:
.
Взаимодействие с карбоновыми кислотами
Взаимодействие между метиловым спиртом и уксусной кислотой приводит к образованию метилацетата. Для отщепления молекул воды необходимо использование серной кислоты:
.
Производство метанола
Химическая промышленность использует метиловый спирт в качестве источника для получения химических веществ, в частности синтетических пластмасс. Поэтому получение метилового спирта очень востребованный процесс в промышленности.
Среди способов получения метилового спирта можно выделить следующие:
- сухая перегонка древесины;
- каталитическое гидрирование оксида и диоксида углерода, который носит название «синтез-газ»;
- каталитическое (неполное) окисление метана.
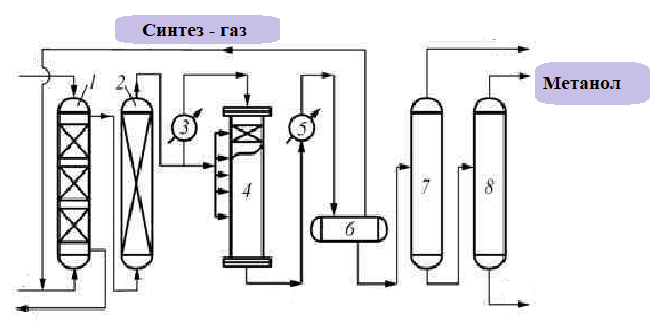
Промышленное получение метанола из «синтез-газа» — это каталитический синтез спирта из монооксида углерода и водорода при 300–400 °С и давления 500 атм в присутствии смеси оксидов цинка и хрома:
.
Упражнение 1
Напишите реакцию образования компонентов синтез-газа из метана.
Контрольные вопросы
1. Аммиак реагирует с оксидами. Может ли он реагировать с кислотами?
2. Что в строении атома азота обусловливает основные свойства аммиака?
3. Какую среду имеет водный раствор аммиака?
4. Синтез аммиака на производстве является экзотермической или эндотермической реакцией?
5. Почему производство аммиака организовано по замкнутой схеме?
6. В какие ещё реакции, помимо указанных, могут вступать спирты?
7. Какой спирт используется для дезинфекции?
8. Почему при попадании метилового спирта внутрь организма нужно выпить этиловый?
Ответы
Упражнение 1
- Аммиак в промышленности
- Физические свойства аммиака
- Химические свойства аммиака
- Производство аммиака
- Физические свойства метанола
- Химические свойства метанола
- Производство метанола
- понимать, чем обусловлены физические и химические свойства аммиака и метанола
- знать особенности химических реакций аммиака и метанола
- знать технологию производства аммиака и метанола
- знать для чего применяется химическая технология
В условиях постоянного развития науки и промышленности химия и химическая технология предлагают миру постоянные инновации. Как правило, их суть заключается в совершенствовании методов переработки сырья в предметы потребления, а также средства производства. Происходит это благодаря целому ряду процессов.
Новые химические технологии позволяют:
- вводить в хозяйственную деятельность новые виды сырья и материалов;
- перерабатывать абсолютно все виды сырья;
- заменять дорогостоящие компоненты более дешёвыми аналогами;
- комплексно использовать материалы: получать из одного вида сырья разные продукты и наоборот;
- внедрять вторичную переработку.
Наука, рассматривающая наиболее экономичные, а также экологически обоснованные методы химической переработки сырых природных материалов в предметы потребления и средства производства, носит название химическая технология.
Химические технологии можно классифицировать по типам веществ, с которыми ведётся работа: органическими и неорганическими.
Химическая технология неорганических веществ — это, например, производство кислот, соды, щелочей, силикатов, минеральных удобрений и солей. Все эти продукты широко используются в разных отраслях промышленности, в частности металлургии, а также в сельском хозяйстве.
В фармацевтике и машиностроении часто используют каучуки, спирт, пластмассы, различные красители. Их производством занимаются предприятия, использующие технологии получения органических веществ.
Аммиак в промышленности
Азотное производство играет важнейшую роль в современной химической промышленности. Стоит заметить, что соединения азота применяются как при получении органических, так и неорганических веществ. Особую статью в азотной промышленности составляет производство аммиака. Именно при «участии» этого ценнейшего компонента производятся удобрения, азотная кислота, взрывчатые вещества, хладагенты и многое другое.
Физические свойства аммиака
При всей своей полезности аммиак является довольно сильным ядом, несмотря на то что применяется в медицине в виде нашатыря.
Аммиак — бесцветный газ с резким удушливым характерным запахом.
Аммиак — ядовитое соединение. Аммиачные пары раздражают слизистую оболочку глаза и кожные покровы. В результате происходит обильное выделение слёз и боль в области лица. Появляется ожог роговицы глаза. Зрение человека ухудшается или происходит полная его потеря. Следом наступает приступ кашля, изменение цвета кожного покрова с сильным раздражением.
При попадании в область дыхательных путей способен токсинами поразить лёгкие и вызвать отёк с поражением разных систем живого организма.
Молекулярная формула аммиака Он имеет резкий запах (нашатырного спирта), легче воздуха, хорошо растворим в воде.
Химические свойства аммиака
В химическом отношении аммиак довольно активен: он вступает в реакции взаимодействия со многими веществами. Степень окисления азота в аммиаке
«−3» — минимальная, поэтому аммиак проявляет только восстановительные свойства. При нагревании аммиака с галогенами, оксидами тяжёлых металлов и кислородом образуется азот.
Пример 1
Написать реакцию между аммиаком и хлором.
Решение
1. Запишем реакцию между аммиаком и хлором:
.
2. Запишем окислительно-восстановительный процесс этой реакции:
6 1 восстановитель,
6
2 3 окислитель.
3. Расставим коэффициенты: .
Аналогично будет идти реакция с оксидами металлов:
.
А также с кислородом (реакция горения) без участия катализатора:
.
Если же в реакции с кислородом участвует катализатор (Pt), то вместо аммиака будет выделяться другой газ — оксид азота (II):
.
Аммиак не проявляет кислотные свойства. Однако атомы водорода в его молекуле всё же способны замещаться на атомы металлов. При полном замещении водорода металлом происходит образование соединений, называемых нитридами, которые также можно получить и при непосредственном взаимодействии азота с металлом при высокой температуре.
Производство аммиака
Процесс производства аммиака характеризуется большой энергоёмкостью, что является главным его недостатком. Именно поэтому постоянно ведутся научные разработки, которые призваны решить проблемы экономии энергии. В настоящее время разрабатываются способы утилизации выделенной энергии, а также совмещение, например производства аммиака и карбамида. Всё это способствует удешевлению деятельности предприятий и повышению их полезной отдачи.

В основу производства аммиака положены принцип циркуляции, согласно которому процесс идёт непрерывно, причём остатки исходных компонентов отделяются от конечного продукта и используются вновь, непрерывно: процесс синтеза происходит без остановки, принцип теплообмена, а также принцип цикличности. Как видно, все эти принципы между собой тесно взаимосвязаны.
Синтез аммиака строится из взаимодействия простых веществ — водорода и азота.
Пример 2
Написать уравнение реакции образования аммиака.
Решение
1. Запишем реакцию между водородом и азотом:
.
2. Запишем окислительно-восстановительный процесс этой реакции:
2 3 восстановитель,
6
6 1 окислитель.
3. Расставим коэффициенты: .
Применение аммиака
Производство аммиака — один из важнейших технологических процессов во всем мире. Ежегодно в мире производят около 100 млн т аммиака. Выпуск аммиака осуществляют в жидком виде или в виде 25%-го водного раствора — аммиачной воды.
Основные направления использования аммиака: производство азотной кислоты (производство азотсодержащих минеральных удобрений в последствии), солей аммония, мочевины, уротропина, синтетических волокон (нейлона и капрона). Аммиак применяют в качестве хладагента в промышленных холодильных установках, в качестве отбеливателя при очистке и крашении хлопка, шерсти и шёлка.
Физические свойства метанола
Метанол — это химическое вещество, которое называется древесным или метиловым спиртом. Его получение не является сложным процессом, поскольку он относится к одноатомным продуктам. Использование данного спирта в алкогольных напитках может привести к пищевому отравлению. Метанол также может образовывать взрывоопасные смеси при температуре 8 градусов по Цельсию.
Метиловый спирт является простейшим одноатомным спиртом, является первым представителем гомологического ряда. Данный спирт представляет собой жидкость, смешивающуюся с водой в любых пропорциях.
Химические свойства метанола
Метанол — неэлектролит, соответственно, в водном растворе не диссоциирует на ионы. Также данное соединение не проявляет кислотные свойства, у него они выражены даже слабее, чем у воды.
Взаимодействие с активными металлами
Метанол не взаимодействует с растворами щелочей, так как образующиеся алкоголяты почти полностью гидролизуются водой. Зато соединение вступает в реакцию с активными металлами. При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
Пример 3
Написать реакцию образования метилата натрия.
Решение
1. Запишем реакцию между метиловым спиртом и натрием:
.
2. Запишем окислительно-восстановительный процесс этой реакции:
2 1 окислитель,
2
1 2 восстановитель.
3. Расставим коэффициенты: .
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла. Так, например, метилат калия разлагается водой:
.
Взаимодействие с карбоновыми кислотами
Взаимодействие между метиловым спиртом и уксусной кислотой приводит к образованию метилацетата. Для отщепления молекул воды необходимо использование серной кислоты:
.
Производство метанола
Химическая промышленность использует метиловый спирт в качестве источника для получения химических веществ, в частности синтетических пластмасс. Поэтому получение метилового спирта очень востребованный процесс в промышленности.
Среди способов получения метилового спирта можно выделить следующие:
- сухая перегонка древесины;
- каталитическое гидрирование оксида и диоксида углерода, который носит название «синтез-газ»;
- каталитическое (неполное) окисление метана.
Промышленное получение метанола из «синтез-газа» — это каталитический синтез спирта из монооксида углерода и водорода при 300–400 °С и давления 500 атм в присутствии смеси оксидов цинка и хрома:
.

Упражнение 1
Напишите реакцию образования компонентов синтез-газа из метана.
Контрольные вопросы
1. Аммиак реагирует с оксидами. Может ли он реагировать с кислотами?
2. Что в строении атома азота обусловливает основные свойства аммиака?
3. Какую среду имеет водный раствор аммиака?
4. Синтез аммиака на производстве является экзотермической или эндотермической реакцией?
5. Почему производство аммиака организовано по замкнутой схеме?
6. В какие ещё реакции, помимо указанных, могут вступать спирты?
7. Какой спирт используется для дезинфекции?
8. Почему при попадании метилового спирта внутрь организма нужно выпить этиловый?
Ответы
Упражнение 1



