- Понятия «раствор», «растворённое вещество», «растворитель»
- Классификация растворов
- Способы решения задач с участием массовой доли
- Роль растворов
- сформировать знания о растворах и массовой доле растворённого вещества
- научиться вычислять массу раствора, массовую долю растворённого вещества в растворе, массу растворённого вещества
- выяснить для чего нужны знания о массовой доле в повседневной жизни
- Что такое доля?
- Чем она может быть выражена?
- Какое понятие тоже даёт нам представление о части от числа?
- Что такое процент?
- Как найти число, если известно, сколько процентов оно составляет от целого?
Понятия «раствор», «растворённое вещество», «растворитель»
Велика роль растворов в возникновении и развитии жизни на Земле. Одной из теорий возникновения организмов является теория зарождения жизни в первичном океане, который представлял собой воду с растворёнными в ней веществами. Из этого раствора организмы получали необходимые для роста и развития ионы и молекулы.
В организме человека находятся физиологически важные растворы. Какие? (Кровь, желудочный сок и др.)
Различные процессы, происходящие в организме, протекают в растворах. Например, усвоение пищи связано с переводом питательных веществ в раствор. В природе водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. В технике такие процессы, как получение соды, удобрений, бумаги, также протекают в растворах.
Так как растворы играют важную роль в жизни человека, изучение их свойств очень важно. Мы с вами выясним, что же такое растворы и попробуем сделать вывод о том, к какому физическому или химическому процессу относится процесс растворения. Что такое раствор и процесс растворения?
Существует несколько теорий растворов.
| Физическую теорию растворов развивали такие учёные, как Я. Х. Вант-Гофф, С. Аррениус, В. Оствальд. Они считали, что процесс растворения является результатом диффузии, т. е. проникновения растворенного вещества в промежутки между молекулами воды. |
 Якоб Хендрик Вант-Гофф
Якоб Хендрик Вант-Гофф
|
 Сванте Август Аррениус
Сванте Август Аррениус
|
Сторонники химической теории, Д. И. Менделеев, И. А. Каблуков, доказывали, что растворение — это результат химического взаимодействия растворённого вещества с молекулами воды.
Доказательством химического взаимодействия служат такие признаки химических реакций, как выделение или поглощение тепла при растворении.
Например, растворение серной кислоты в воде протекает с выделением большого количества тепла, раствор может закипеть. Растворение же такого вещества, как нитрата калия, сопровождается, наоборот, поглощением тепла.
В результате химического взаимодействия образуются соединения гидраты — непрочные соединения веществ с водой, существующие в растворе. Косвенным доказательством гидратации является существование твёрдых кристаллогидратов.
Кристаллогидраты — соли и другие твёрдые вещества, в состав которых входит вода. В этом случае вода называется кристаллизационной.
К кристаллогидратам относится хорошо известная всем соль голубого цвета — медный купорос .
Проведём небольшой эксперимент.
Насыплем небольшое количество
Отметьте цвет вещества (ярко-синий). |

|
Нагреем.
Что наблюдаете?
В чём причина
|

|

|
Добавим к сухому
Что наблюдаете? |

|

|
Изменение цвета сульфата меди (II) при растворении его в воде на синий является ещё одним доказательством химической теории растворов.
В настоящее время принята теория, объединяющая обе точки зрения, — физико-химическая теория.
Растворение — физико-химический процесс.
Растворы — гомогенные системы, состоящие из растворителя, растворённого вещества и продуктов их взаимодействия.
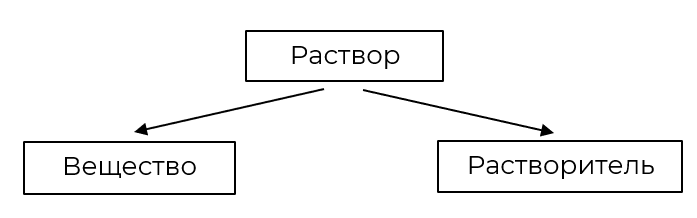
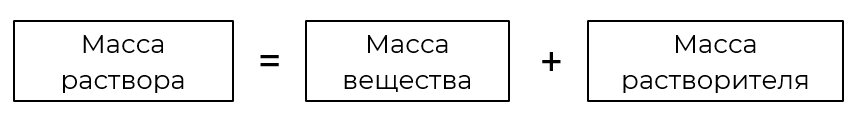
(р-ра)(в-ва)(р-ля)
Классификация растворов
По агрегатному состоянию
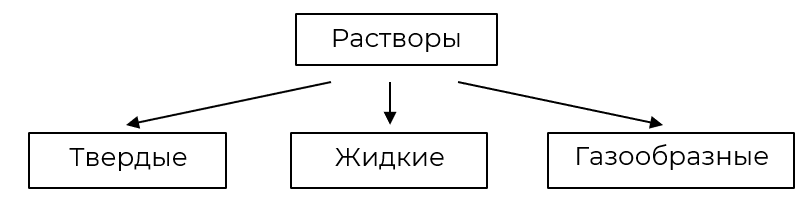

Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость. Наиболее распространённым растворителем из неорганических веществ, конечно же, является вода. Из органических веществ в качестве растворителей используют метанол, этанол, диэтиловый эфир, ацетон, бензол, четырёххлористый углерод и др.
 Рис. 1. Аптечные препараты растворов: йода, пероксида водорода, аммиака
Рис. 1. Аптечные препараты растворов: йода, пероксида водорода, аммиака
На этикетках разнообразных растворов, используемых в быту, можно прочитать содержание в них растворённого вещества. Например, уксусная кислота 70 %, настойка йода 5 %.
Это один из способов выражения концентрации растворов, который называют массовой долей (w).
Массовая доля растворённого вещества в растворе — отношение массы растворённого вещества к массе раствора.
,
где — массовая доля растворённого вещества в растворе; — масса растворённого вещества; — масса раствора.
На практике отмерять массу раствора очень неудобно, удобнее брать необходимый объём. Для его расчёта необходимо знать плотность раствора, которая показывает массу единицы объёма и связана с массой и объёмом раствора формулой:
.
Чаще всего плотность жидкостей указывают в г/мл, но встречаются и другие размерности: г/см3, 1 кг/л, 1 000 кг/м3.
Способы решения задач с участием массовой доли
Пример 1
В растворе массой 100 г содержится хлорид бария массой 20 г. Какова массовая доля хлорида бария в растворе?
Дано: Решение:
m(р-ра) = 100 г; Массовая доля ВаСl2 равна отношению его
массы к общей массе раствора:
m(ВаСl2) = 20 г.
Найти:
Ответ: .
Пример 2
К 250 г 10%-го раствора глюкозы прилили 150 мл воды. Какова массовая доля (%) глюкозы в полученном после разбавления растворе?
Дано: Решение:
m1(р-ра) = 250 г; 1. Определим массу глюкозы в исходном
w1(глюкозы) = 10 %, растворе:
или 0,1;
V(H2O)=150 мл
Найти:
2. Масса глюкозы при разбавлении не
изменяется. Определим массу раствора,
полученного после разбавления:
;
;
;
.
3. Определим :
;
.
Ответ: .
Упражнение
- Сколько грамм соды содержится в 200 г 40%-го раствора?
- Найдите массу 10%-го раствора сахара, если известно, что сахара в растворе 25 г.
Роль растворов
|
В природе
|
В медицине
|
В быту
|
|
97 % поверхности земного шара занимают океаны и моря, 3 % — озёра, реки, подземные воды.
Тело медузы состоит на 99,9 % из воды.
|
Для дезинфекции ран используется 5%-й раствор марганцовки. В домашней аптечке всегда есть 3%-й раствор «зелёнки».
|
Для засолки огурцов необходим 9%-й раствор соли.
Для приготовления компота на зиму необходимо сварить 30%-й сахарный сироп.
|
В процессе растворения частицы (ионы или молекулы) растворяемого вещества под действием хаотически движущихся частиц растворителя переходят в раствор, образуя в результате беспорядочного движения частиц качественно новую однородную систему. Способность к образованию растворов выражена у разных веществ в различной степени. Одни вещества способны смешиваться друг с другом в любых количествах (вода и спирт), другие — в ограниченных (хлорид натрия и вода).
Контрольные вопросы
- Что показывает массовая доля растворённого вещества в растворе?
- Для чего нужны знания о массовой доле?
- Пригодятся ли знания о массовой доле в жизни?
Упражнение
- m (соды) — 80 г.
- m (раствора) — 250 г.

