- Кислород как химический элемент
- История открытия и изучения кислорода
- Кислород как простое вещество. Физические свойства кислорода
- Способы получения кислорода
- сформировать знания о кислороде как о химическом элементе, так и простом веществе
- рассмотреть распространение кислорода в природе
- изучить физические свойства кислорода
- познакомиться с историей открытия кислорода
В чём горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без…
(Кислорода!)
Кислород как химический элемент
«Кислород — словообразовательная калька французского «oxygene», неологизм Лавуазье, это сложение греческих слов «oxis» — кислый и «gennao» — рождаю. Окончательно закрепилось в первой половине XIX в. До этого кислород назывался также «кислородным газом, оксигеном, кислотвором».
|
Кислород — химический элемент:
|

|
Латинское название кислорода — оксигениум — рождающий кислоты. Этот элемент решили назвать так, потому что кислород встречался во многих кислотах, которые были известны к моменту открытия элемента.
Кислород — один из самых распространённых элементов на Земле.
 Рис. 1. Содержание кислорода в земной коре
Рис. 1. Содержание кислорода в земной коре
В атмосфере — 21 %.
В гидросфере — 86 %.
В земной коре (литосфере) —
49 %.
В организме человека — 60 %.
Кислорода в природе ровно столько, сколько всех остальных элементов вместе взятых.
История открытия кислорода и изучения кислорода
Простое вещество кислород входит в состав воздуха. Английский врач Дж. Пристли ещё в 1771 году показал, что воздух может изменять свой состав и становиться непригодным для дыхания и горения. А в 1774 году Пристли получил газообразный кислород путём разложения оксида ртути:
.
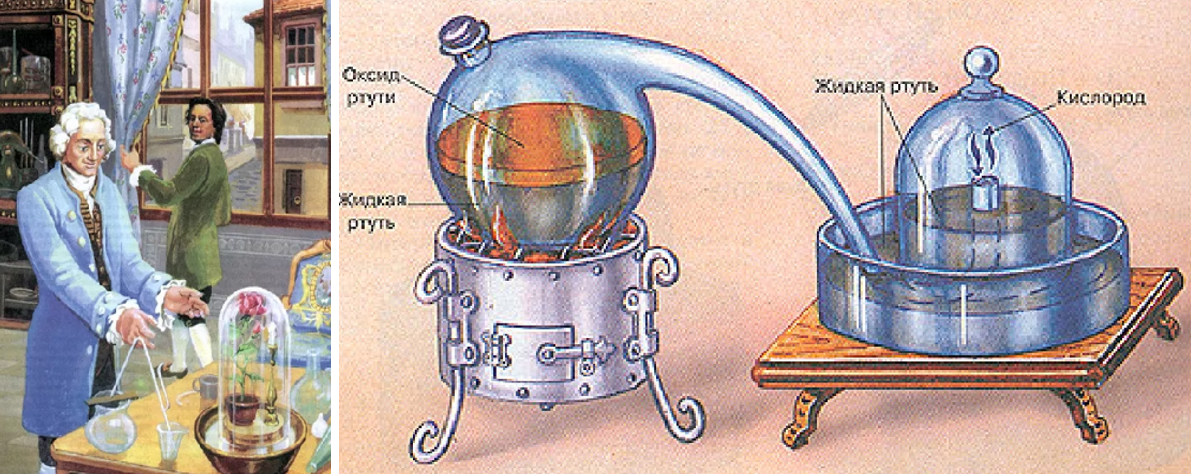 Рис. 2. Опыты Дж. Пристли
Рис. 2. Опыты Дж. Пристли
Вот как об этом писал сам Джозеф Пристли: «1 августа 1774 г. я попытался извлечь воздух из ртутной окалины (оксида ртути) и нашёл, что воздух легко может быть изгнан из неё посредством линзы. Этот воздух не поглощался водой. Каково же было мое изумление, когда я обнаружил, что свеча горит в этом воздухе необычайно ярким пламенем. Тщетно пытался я найти объяснение этому явлению».
 К. В. Шееле (1742–1786)
К. В. Шееле (1742–1786)
Впервые кислород получил в 1770 году знаменитый шведский химик Карл-Вильгельм Шееле при нагревании селитры — нитрата калия KNO3.
Но сообщение об этом было опубликовано позже, чем открытие Пристли.
И всё-таки главной фигурой в истории открытия кислорода считается не Шееле и не Пристли. Они открыли новый газ — и только.
Собственно, открывшим кислород остаётся французский химик Антуан Лавуазье. В 1775 году он исследовал кислород и создал кислородную теорию горения, которая пришла на смену теории флогистона (теория огненной материи).
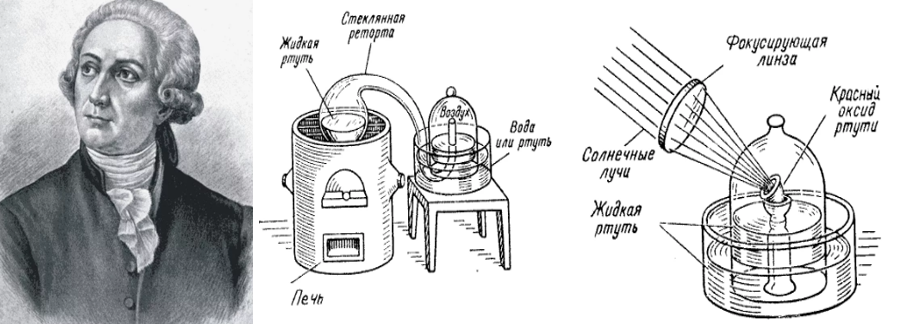 Рис. 3. Рисунок опытов и портрет Лавуазье
Рис. 3. Рисунок опытов и портрет Лавуазье
За два века, которые прошли со времени открытия, теория Лавуазье не только не была опровергнута, но ещё более укрепилась. Лавуазье дал название кислороду oxygenium — рождающий кислоту.
Кислород — простое вещество. Физические свойства кислорода
- Кислород — это газ без цвета, без вкуса, без запаха.
- Кислород малорастворим в воде, с повышением температуры растворимость газа в воде уменьшается. При 0 °C в 100 V воды растворяется 5 V кислорода. При 20 °C в 100 V воды растворяется 3 V кислорода. Кислородом, растворённым в воде, дышат все организмы, живущие в ней.
- ρ = 1, 429 г/л (при 0 °C и 1 атм)
- t кип. = –183 °C t пл. = –219 °C
- При t = –183 °C и атмосферном давлении 101,3 кПа кислород переходит в жидкое состояние.
- Жидкий кислород — это голубая подвижная жидкость, притягиваемая магнитом.
- При t = –219 °C кислород затвердевает, образуя синие кристаллы.
- Кислород немного тяжелее воздуха: 1 л кислорода имеет массу 1,43 г, а 1 л воздуха — 1,29 г.
Мr(кислорода) = 32, Мr(воздуха) = 29.
Способы получения кислорода


К. А. Тимирязев (1843–1920) — крупный ботаник-физиолог, замечательный исследователь жизни растений. Является основоположником научного направления по изучению фотосинтеза. Один из главнейших трудов — «Солнце, жизнь и хлорофилл».
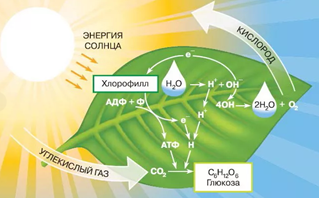 Рис. 4. Фотосинтез
Рис. 4. Фотосинтез
«Дайте самому лучшему повару сколько угодно солнечного света, чистого воздуха, целую речку чистой воды и попросите, чтобы из всего этого он приготовил вам сахар, крахмал, жиры и зерно, — он решит, что вы над ним смеетесь. Но то, что кажется совершенно фантастическим человеку, беспрепятственно совершается в зелёных листьях растений».
А знаете ли вы, что после дождей с грозой в воздухе часть кислорода превращается в озон? Формула озона О3.
 Рис. 5. Образование озона
Рис. 5. Образование озона
Именно озон придает воздуху приятный свежий запах. Также озон образуется при распаде смол хвойных деревьев. Небольшое содержание озона в воздухе полезно, благотворно действует на организм (особенно при болезнях дыхательных путей).
Напротив, в более высоких концентрациях озон сильно ядовит.
Кислород на Земле — самый распространённый элемент. Воздух, которым мы дышим, на 21 % состоит из кислорода. В морях и океанах, в земных минералах и в живых организмах есть кислород. Почти половина массы земной коры приходится на кислород, связанный в виде различных соединений. В первую очередь это вода Н2О.
Кислород — самый жизненно важный элемент: он обеспечивает обмен веществ в живой природе. К человеку и животным в организм кислород попадает в процессе дыхания. В лёгких, пронизанных кровеносными сосудами, кислород связывается с кровью, а кровь затем переносит его по всему телу к клеткам мышц, внутренних органов и мозга. Но в природе кислород не только расходуется, но и образуется, его запасы в атмосфере постоянно пополняются.
Контрольные вопросы
- В результате какого процесса кислород О2 образуется в природе в листьях зелёных растений на свету?
- Назовите имя английского учёного, одного из открывателей кислорода.
- Как называется вещество, молекула которого состоит из 3 атомов кислорода?
- Назовите тип реакции получения кислорода из кислородсодержащих веществ в лаборатории.
- Как называется воздушная оболочка земли, где содержание кислорода составляет 21 %?

