- Химические реакции
- Признаки и условия протекания химических реакций
- Реакции горения
- Классификация по тепловому эффекту
- сформировать знания об отличии физических явлений от химических реакций
- познакомиться с признаками и условиями протекания химических реакций
- сформировать первоначальное представление о классификации химических реакций по тепловому эффекту
- изучить понятия об экзо- и эндотермических реакциях
Какие признаки, которые можно наблюдать с помощью органов чувств, указывают на протекание химической реакции?
Химические реакции
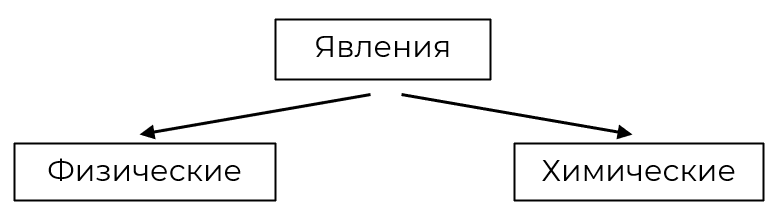
Человек и всё, что его окружает, — живая и неживая природа — непрерывно изменяются. Вся живая и неживая природа состоит из веществ. Изменения, происходящие с веществами, называются явлениями. А какие же бывают явления?
|
Физические
|
Химические
|
|
Состав вещества остаётся без изменений, меняется лишь его агрегатное состояние или форма и размеры тел.
|
Изменяется состав вещества.
|
|
|
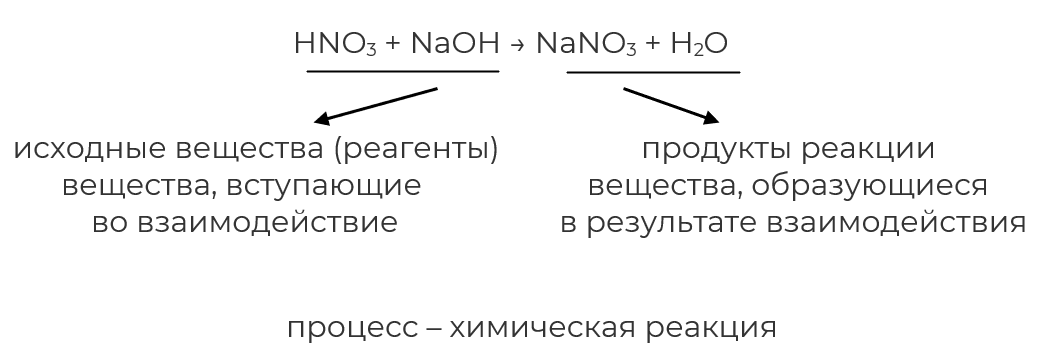
Химические реакции — это такие явления, при которых одни вещества (исходные вещества, или реагенты) превращаются в другие (продукты реакции) с новыми свойствами.
Признаки и условия протекания химических реакций
Важным итогом химической реакции является образование новых веществ, а у новых веществ, конечно же, будут и новые свойства. Поэтому химические реакции часто сопровождаются внешними признаками.
Таблица 1. Признаки протекания химических реакций
|
Признак
|
Опыт
|
Демонстрация
|
|
Выпадение и
|
Получение гидроксида меди (II).
Реакция взаимодействия двух
.
|

|
|
Растворение полученного
При добавлении к осадку .
|

|
|
|
Изменение
|
Взаимодействие хлорида
Реакция приводит к .
|

|
|
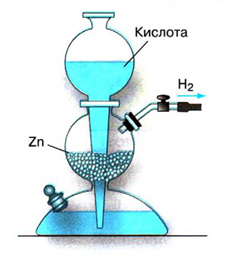
Выделение
|
Взаимодействие металла с
|

|
|
Получение водорода в
.
|
|
|
|
Выделение
|
Горение магниевой стружки.
При горении магния возникает
|

|
|
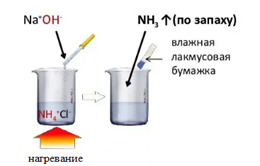
Выделение
|
Взаимодействие щелочи с
Реакция происходит при .
|
|
|
Разложение дихромата аммония, В ходе реакции выделяется
|

|
Условия для протекания химических реакций:
- Соприкосновение (измельчение вещества, перемешивание) - обязательное условие для протекания любой реакции.
- Нагревание.
- Действие электрического тока, света.
Для протекания некоторых реакций требуется нагревание. Например, если мы откроем крышку склянки, в которой хранится сера, несмотря на её соприкосновение с кислородом воздуха, реакция не начнётся. Но стоит только поджечь порошок серы, он начнёт гореть бледно-голубым пламенем.
Реакции горения
Реакции горения — химические реакции, идущие с выделением теплоты и света.
Реакции горения — это частный случай большой группы химических реакций, идущих с выделением теплоты.
Но есть реакции, которым для их протекания необходима теплота.
Классификация по тепловому эффекту
|
Экзотермические
|
Эндотермические
|
|
Реакции, протекающие с выделением теплоты («экзо» означает — наружу).
|
Реакции, протекающие с поглощением теплоты («эндо» означает — внутрь).
|
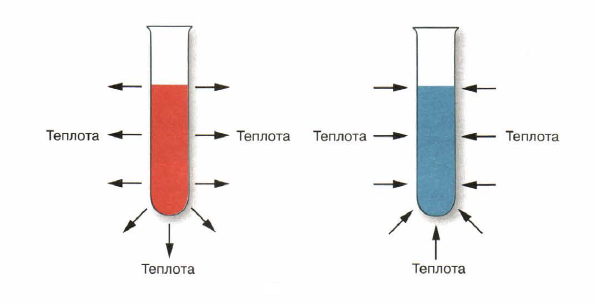 Рис. 1. Реакции: а — экзотермические; б — эндотермические
Рис. 1. Реакции: а — экзотермические; б — эндотермические
Знание условий возникновения и протекания химических реакций позволяет управлять этими процессами, например, прекращать реакции горения — тушить пожары. Чтобы погасить пламя, нужно прекратить доступ кислорода к горящему предмету. Для этого пламя накрывают плотной тканью (противопожарным полотном), засыпают песком или используют огнетушители.
Контрольные вопросы
- Что такое химические реакции?
- Что такое реагенты и продукты реакции?
- Назовите признаки химических реакций.

